上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Cell | 继 Nature 后再添顶刊!林鸿宣院士团队破译水稻耐热三级调控机制,推动从实验室机制解析到田间按需育种应用的转化
287 人阅读发布时间:2025-12-26 10:25
 温度升高可加速植物生长速度、一定程度提高光合作用效率、扩大植物生长分布范围。而当温度过高,尤其在全球持续变暖的大背景下,植物如何应对高温来袭?应对温度这把双刃剑?
中国科学院分子植物科学卓越创新中心林鸿宣院士研究团队与上海交通大学林尤舜研究团队,继年初合作在国际权威学术期刊《自然》(Nature,IF48.5)发表文章后,2025年12月,在Cell(IF42.5)在线发表题为“A stepwise decoding mechanism for heat sensing inplants connects lipid remodeling to a nuclear signaling cascade”的文章,该研究基于前期发现的耐热负调控因子—G蛋白γ亚基TT2(Nature Plants),整合转录组和脂质组分析,进一步揭示TT2的调节机制。首次在植物中揭示了“脂质信号-核cAMP-ROS稳态的三级信号链,将上游物理信号(热)与下游生理响应(抗氧化)”串联起来。
温度升高可加速植物生长速度、一定程度提高光合作用效率、扩大植物生长分布范围。而当温度过高,尤其在全球持续变暖的大背景下,植物如何应对高温来袭?应对温度这把双刃剑?
中国科学院分子植物科学卓越创新中心林鸿宣院士研究团队与上海交通大学林尤舜研究团队,继年初合作在国际权威学术期刊《自然》(Nature,IF48.5)发表文章后,2025年12月,在Cell(IF42.5)在线发表题为“A stepwise decoding mechanism for heat sensing inplants connects lipid remodeling to a nuclear signaling cascade”的文章,该研究基于前期发现的耐热负调控因子—G蛋白γ亚基TT2(Nature Plants),整合转录组和脂质组分析,进一步揭示TT2的调节机制。首次在植物中揭示了“脂质信号-核cAMP-ROS稳态的三级信号链,将上游物理信号(热)与下游生理响应(抗氧化)”串联起来。

研究材料
(1)野生型株系:水稻热敏品种(华粳籼,HJX)、耐热品种(TT2功能缺失,NIL-TT2HPS32)、ZH11;(2)转基因过表达株系:DGK7过表达株系(DGK7OE/HJX)、MdPDE1过表达株系(MdPDE1OE/ZH11)、MdPDE1过表达株系(MdPDE1OE/ NIL-TT2HPS32)、RGb1过表达株系(RGB1OE/HJX)、DGK7过表达TT2功能缺失株系(DGK7OE/NIL-TT2HPS32)、DGK7过表达TT2过表达株系(TT2OE/DGK7OE/NIL-TT2HPS32)
研究结果
1. 二酰甘油激酶7(DGK7)可连接G蛋白与热胁迫下的脂质信号,进而将热胁迫的生理信号转变为脂质代谢的分子信号
为筛选参与热信号传递的关键调控因子,作者基于先前的热胁迫转录组数据,按照:
(1)快速响应热应激并在热暴露期间持续高表达;
(2)一旦热信号被移除就下调表达;
的规则共筛选到479个差异表达基因(说明这些基因受温度调控)。随后,使用水稻热敏品种(华粳籼,HJX)和耐热品种(NIL-TT2HPS32)进行转录组分析。在NIL-TT2HPS32中下调表达的基因主要参与“脂质相关”途径。韦恩分析表明,有4个基因同时存在于脂质途径和上述479个基因中,暗示其参与热诱导脂质重塑。并且这4个基因中Os01G0783200可编码DGK7,将甘油二酯(DAG)磷酸化为PA32。广靶脂质组提示DAG(DAG36:3和DAG36:2)在组间显著差异表达。整体结果表明:DGK7以DAG为底物,将TT2调控的G蛋白信号与热应激下的脂质调节联系起来。
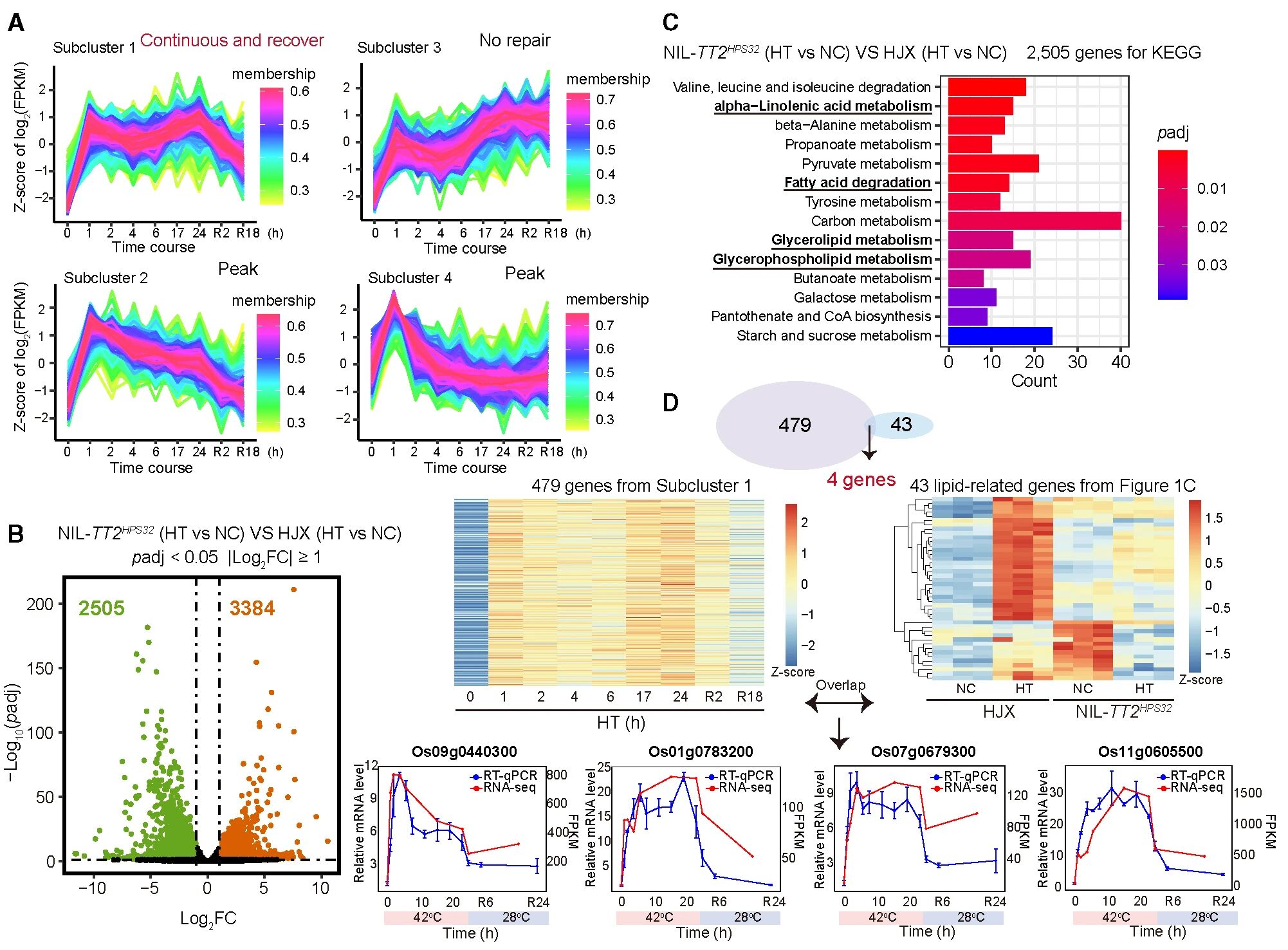 图1 组学分析揭示DGK7在热胁迫反应中的脂质代谢过程
由于TT2必须与水稻Gβ亚基(RGb1)形成二聚体传递信号,作者在HJX背景下获得过表达RGb1的转基因植物(RGB1OE/HJX)。发现,与野生型HJX相比,RGB1OE/HJX植株的耐热性和存活率降低,该结果在拟南芥中得到证实。表明,RGB1可负调节水稻耐热性。转录组GSEA结果表明:G蛋白偶联受体信号通路与热应激处理正相关,且DGK7位于此通路中,表明DGK7可能是一个重要的热信号解码因子,可连接G蛋白信号与脂质代谢。
图1 组学分析揭示DGK7在热胁迫反应中的脂质代谢过程
由于TT2必须与水稻Gβ亚基(RGb1)形成二聚体传递信号,作者在HJX背景下获得过表达RGb1的转基因植物(RGB1OE/HJX)。发现,与野生型HJX相比,RGB1OE/HJX植株的耐热性和存活率降低,该结果在拟南芥中得到证实。表明,RGB1可负调节水稻耐热性。转录组GSEA结果表明:G蛋白偶联受体信号通路与热应激处理正相关,且DGK7位于此通路中,表明DGK7可能是一个重要的热信号解码因子,可连接G蛋白信号与脂质代谢。
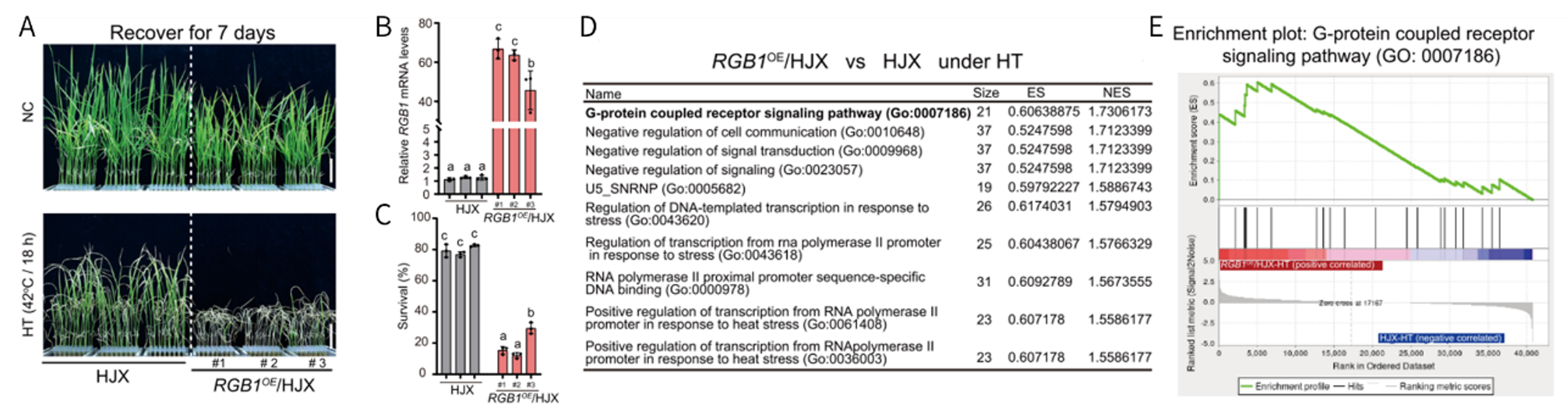 图2 G蛋白信号转导与热胁迫下的脂质代谢有关
过表达DGK7,可增加水稻幼苗的耐热性和存活率。抑制DGK7表达,水稻耐热性也随之降低。说明DGK7可正向调控水稻耐热性,而同时过表达TT2时(TT2OE/DGK7OE/NIL-TT2HPS32),DGK7的正调控过程消失,说明TT2可抑制DGK7的功能且DGK7作为TT2的下游发挥作用。
图2 G蛋白信号转导与热胁迫下的脂质代谢有关
过表达DGK7,可增加水稻幼苗的耐热性和存活率。抑制DGK7表达,水稻耐热性也随之降低。说明DGK7可正向调控水稻耐热性,而同时过表达TT2时(TT2OE/DGK7OE/NIL-TT2HPS32),DGK7的正调控过程消失,说明TT2可抑制DGK7的功能且DGK7作为TT2的下游发挥作用。
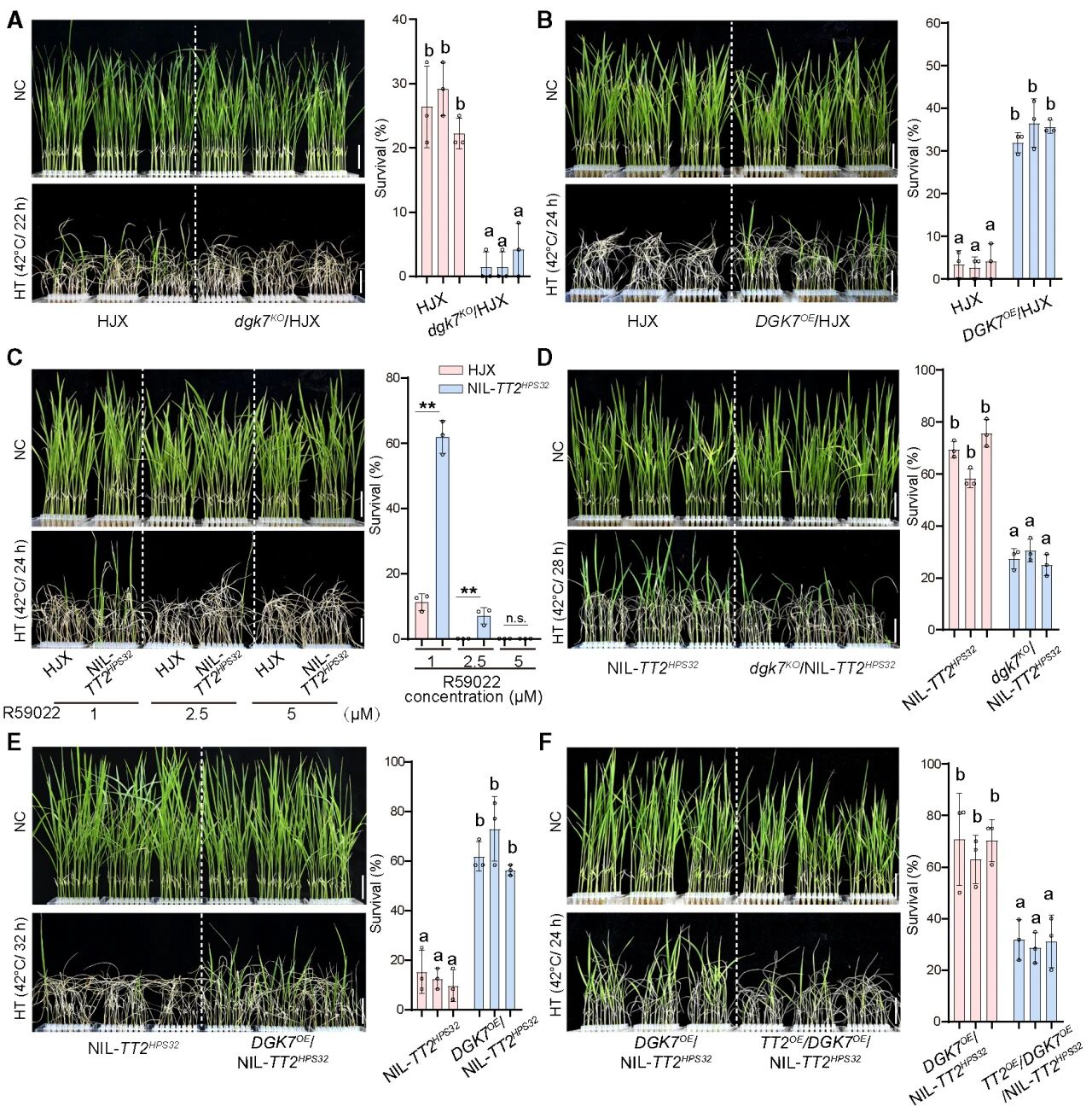 图3 DGK7作为TT2的下游,正向调控水稻耐热性
2. DGK7与TT2在细胞质膜上发挥生物功能,该定位不受热胁迫而改变
瞬时表达实验表明DGK7与TT2同时在质膜中表达且DGK7的定位不依赖于TT2是否存在。热胁迫也不会改变DGK7与TT2在质膜中的表达位置。双分子荧光互补(BiFC)、分离荧光素酶互补(SFLC)、免疫共沉淀(coIP)表明DGK7在质膜上与TT2和RGB1存在特异性物理互作,且该过程不受热胁迫影响。
图3 DGK7作为TT2的下游,正向调控水稻耐热性
2. DGK7与TT2在细胞质膜上发挥生物功能,该定位不受热胁迫而改变
瞬时表达实验表明DGK7与TT2同时在质膜中表达且DGK7的定位不依赖于TT2是否存在。热胁迫也不会改变DGK7与TT2在质膜中的表达位置。双分子荧光互补(BiFC)、分离荧光素酶互补(SFLC)、免疫共沉淀(coIP)表明DGK7在质膜上与TT2和RGB1存在特异性物理互作,且该过程不受热胁迫影响。
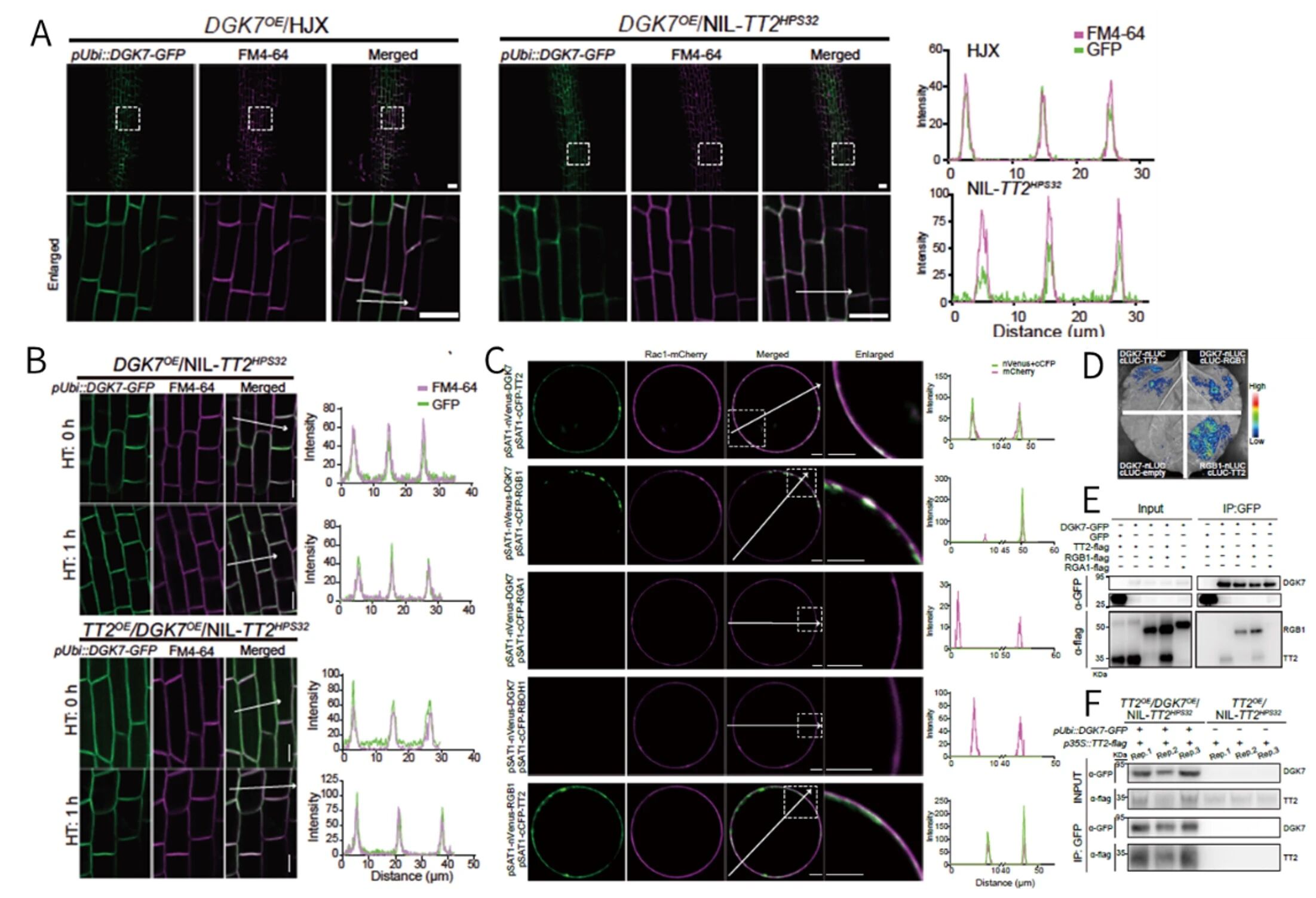 图4 DGK7与TT2和RGB1的相互作用
3. TT2通过Ser477去磷酸化,抑制DGK7激酶活性
有研究报道DGKs磷酸化可将DAG转化为PA。对表达的重组蛋白DGK7进行纯化,并通过其对三磷酸腺苷的消耗来量化DGK活性。发现,当DAG存在时,DGK活性显著增强。过表达DGK7株系可显著降低总DAG水平并增加PA积累,当DGK7与TT2双过表达时(TT2OE/DGK7OE/NIL-TT2HPS32),总DAG和PA表达水平与对照组NIL-TT2HPS32无显著差异。整体结果表明:DGK7在体内和体外都具有DGK活性,并有助于PA的积累,而TT2可对其进行负调控。
图4 DGK7与TT2和RGB1的相互作用
3. TT2通过Ser477去磷酸化,抑制DGK7激酶活性
有研究报道DGKs磷酸化可将DAG转化为PA。对表达的重组蛋白DGK7进行纯化,并通过其对三磷酸腺苷的消耗来量化DGK活性。发现,当DAG存在时,DGK活性显著增强。过表达DGK7株系可显著降低总DAG水平并增加PA积累,当DGK7与TT2双过表达时(TT2OE/DGK7OE/NIL-TT2HPS32),总DAG和PA表达水平与对照组NIL-TT2HPS32无显著差异。整体结果表明:DGK7在体内和体外都具有DGK活性,并有助于PA的积累,而TT2可对其进行负调控。
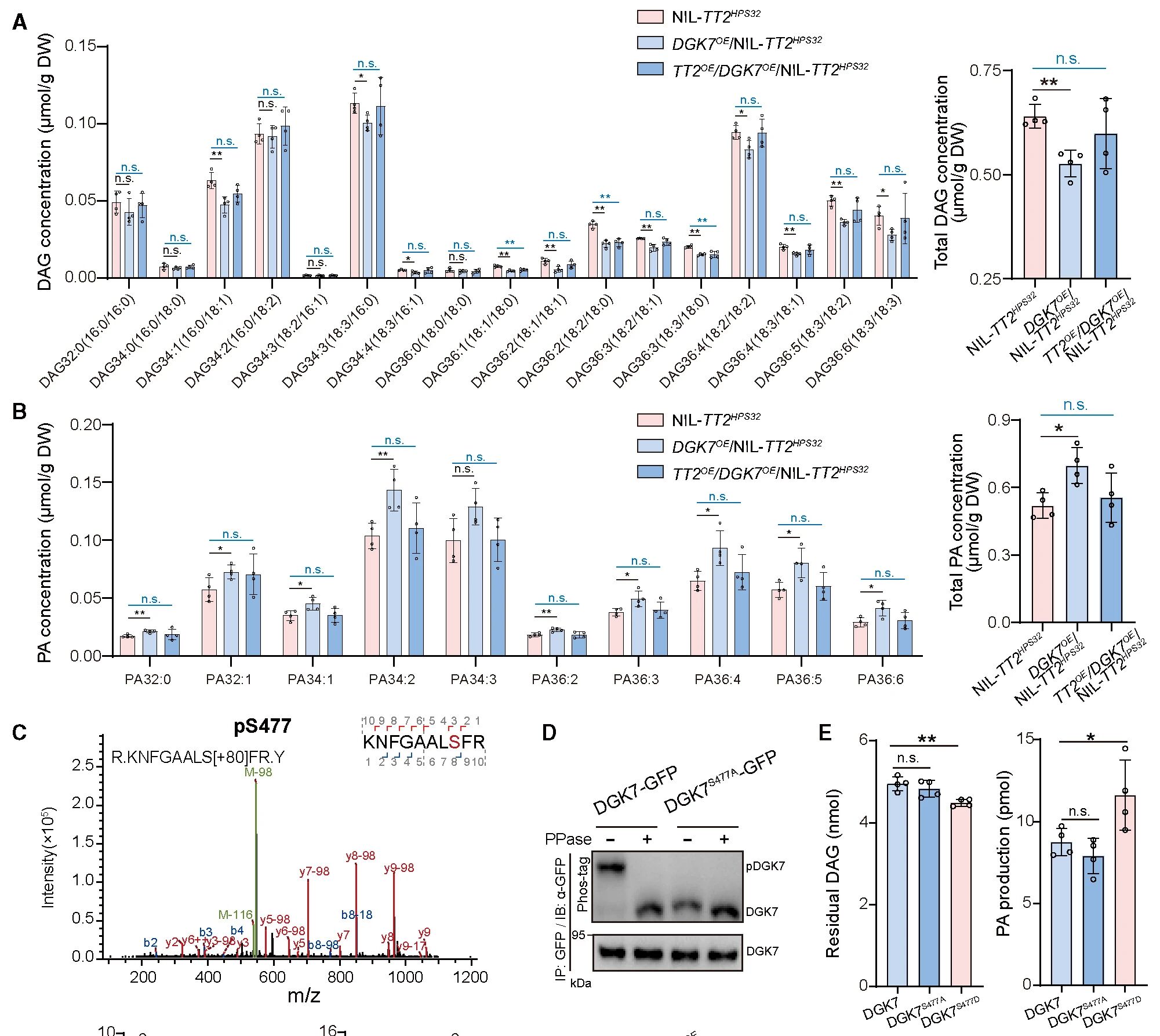 图5 TT2通过Ser477去磷酸化抑制DGK7激酶活性
对NC组、热敏感组(HJX)和热耐受组(NIL-TT2HPS32)进行广靶脂质组检测,揭示TT2在热刺激下对DAG和PA代谢的影响。发现,与NC相比,NIL-TT2HPS32的PA总量增加大于HJX,而DAG积累量小于HJX,表明热胁迫下TT2可通过抑制DGK7活性,增加DAG积累和降低PA活性。结合转录组、脂质组、修饰蛋白鉴定进一步揭示机制:热胁迫下,TT2可通过去磷酸化抑制DGK7中Ser477位点的磷酸化过程,降低DGK7活性,降低DGK7对DAG转化至PA的过程,使积累DAG,PA表达水平降低。
图5 TT2通过Ser477去磷酸化抑制DGK7激酶活性
对NC组、热敏感组(HJX)和热耐受组(NIL-TT2HPS32)进行广靶脂质组检测,揭示TT2在热刺激下对DAG和PA代谢的影响。发现,与NC相比,NIL-TT2HPS32的PA总量增加大于HJX,而DAG积累量小于HJX,表明热胁迫下TT2可通过抑制DGK7活性,增加DAG积累和降低PA活性。结合转录组、脂质组、修饰蛋白鉴定进一步揭示机制:热胁迫下,TT2可通过去磷酸化抑制DGK7中Ser477位点的磷酸化过程,降低DGK7活性,降低DGK7对DAG转化至PA的过程,使积累DAG,PA表达水平降低。
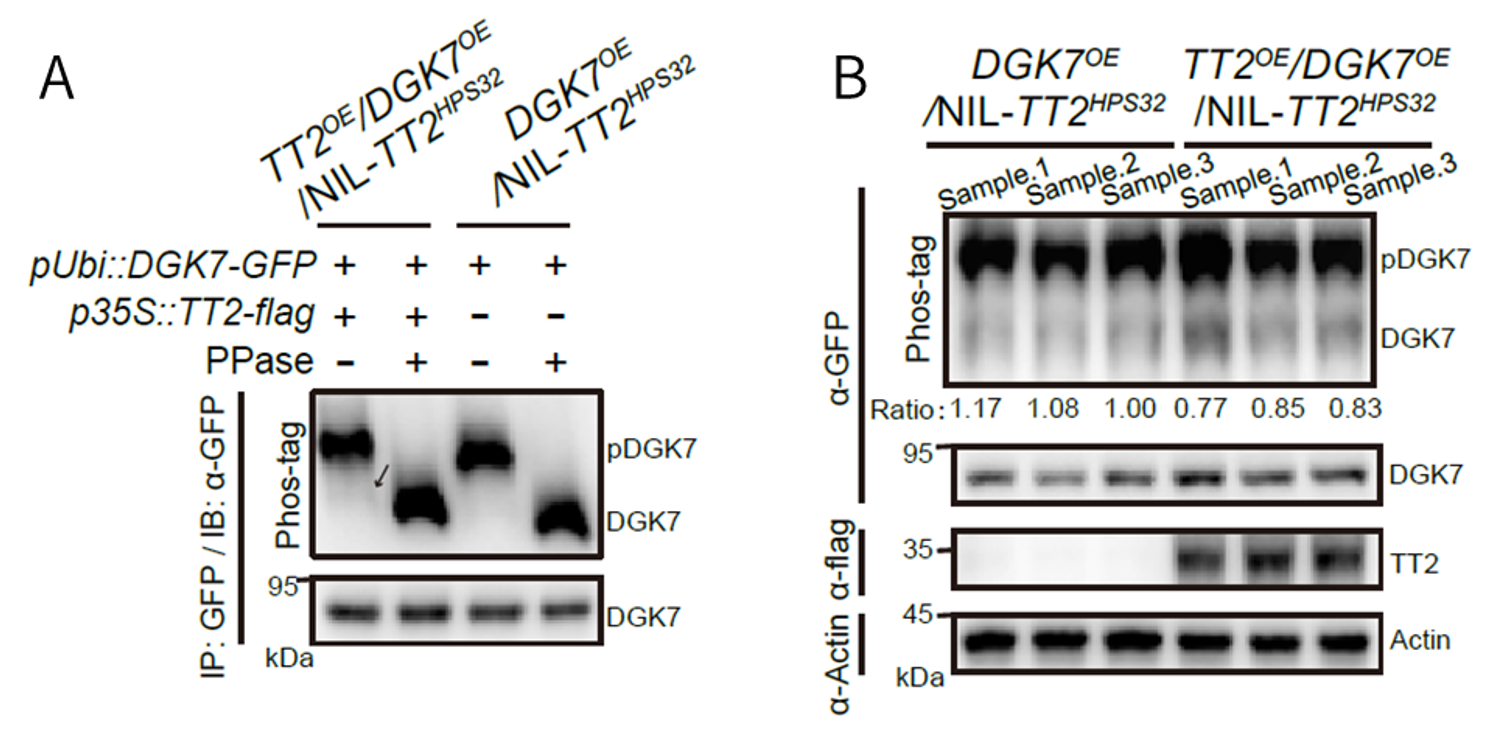 图6 TT2通过Ser477去磷酸化抑制DGK7激酶活性
4. DGK7负调节环核苷酸单磷酸(cAMP)的产生
如何深入了解DGK7介导的脂质变化如何将物理热信号解码为生物细胞内生物学响应?
序列比对发现DGK成员中有6个含有腺酰环化酶(AC)基序的关键残基,提示DGK7在cAMP产生中发挥作用。体外DGK7酶活性测定发现,DGK7无法水解cAMP为腺苷-磷酸(AMP)。结合RNA-seq分析正常条件和20h热胁迫下,DGK7过表达株系中,热响应基因的表达模式与cAMP下调基因高度重叠,表明DGK7的转录调控效应与cAMP信号相反。整体结果表明,DGK7本身不具有环化酶和磷酸二酯酶活性,无法直接催化cAMP,但可通过间接机制负向调控cAMP水平。
图6 TT2通过Ser477去磷酸化抑制DGK7激酶活性
4. DGK7负调节环核苷酸单磷酸(cAMP)的产生
如何深入了解DGK7介导的脂质变化如何将物理热信号解码为生物细胞内生物学响应?
序列比对发现DGK成员中有6个含有腺酰环化酶(AC)基序的关键残基,提示DGK7在cAMP产生中发挥作用。体外DGK7酶活性测定发现,DGK7无法水解cAMP为腺苷-磷酸(AMP)。结合RNA-seq分析正常条件和20h热胁迫下,DGK7过表达株系中,热响应基因的表达模式与cAMP下调基因高度重叠,表明DGK7的转录调控效应与cAMP信号相反。整体结果表明,DGK7本身不具有环化酶和磷酸二酯酶活性,无法直接催化cAMP,但可通过间接机制负向调控cAMP水平。
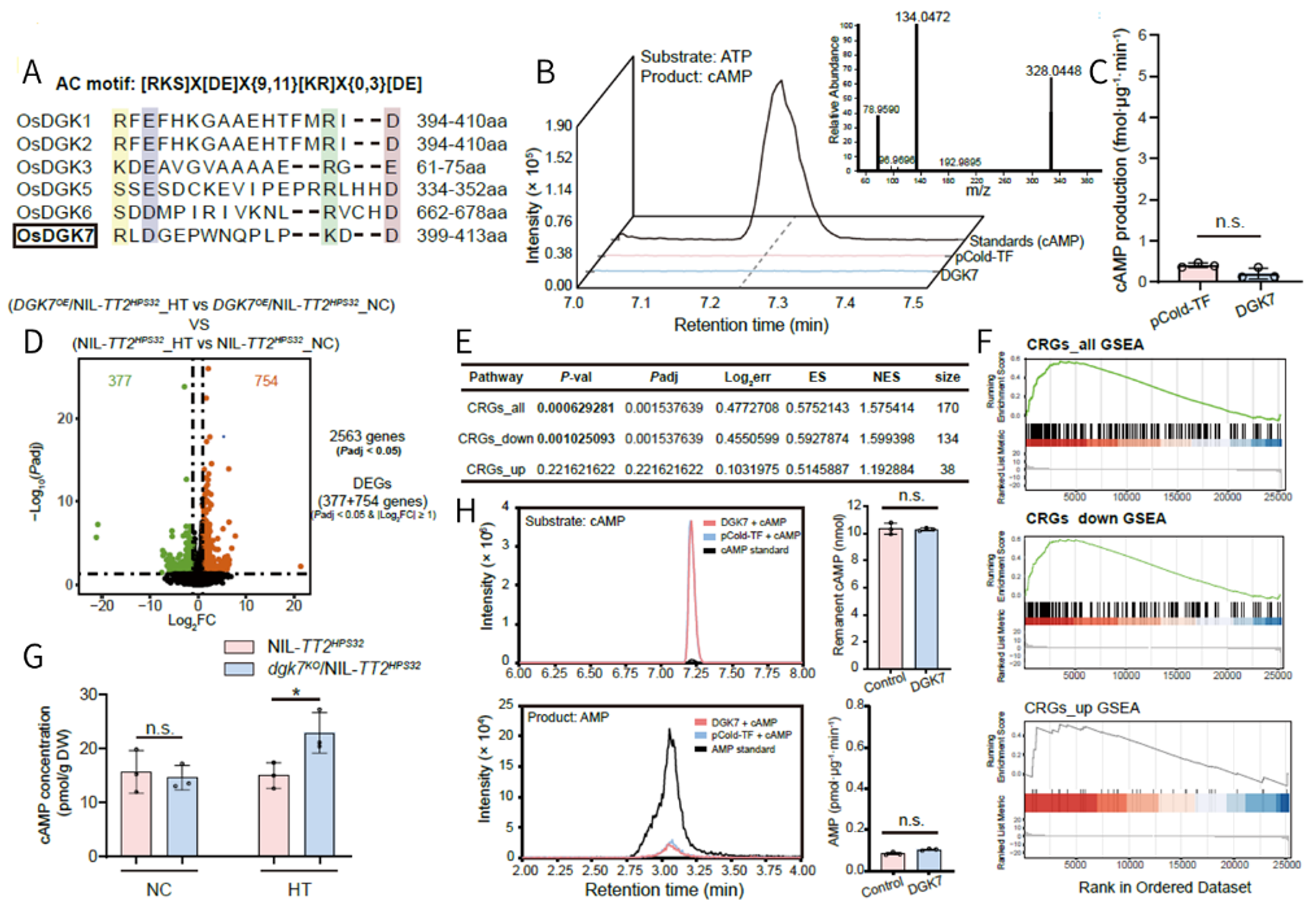 图7 DGK7无环化酶活性但可以间接负调控cAMP表达
5. DGK7可通过MdPDE1与磷酸酯(PA)结合来调控cAMP水解过程
由于DGK7本身不具备环化酶(PDE)活性,无法直接降解cAMP。作者假设应该存在一个中间分子,该分子具有PDE活性并具有感知DGK7产生的PA信号,可以与PA结合,从而实现DGK7对cAMP的间接负调控。
通过分析PDE与PA的结合基序,作者将目光聚焦到一个金属依赖的磷酸二酯酶(MdPDE1)。通过体外酶活验证、体内功能验证表明,MdPDE1可感知DGK7产生的PA信号,与PA结合降解cAMP,从而将脂质信号转化为cAMP信号,最终赋予水稻耐热性。
图7 DGK7无环化酶活性但可以间接负调控cAMP表达
5. DGK7可通过MdPDE1与磷酸酯(PA)结合来调控cAMP水解过程
由于DGK7本身不具备环化酶(PDE)活性,无法直接降解cAMP。作者假设应该存在一个中间分子,该分子具有PDE活性并具有感知DGK7产生的PA信号,可以与PA结合,从而实现DGK7对cAMP的间接负调控。
通过分析PDE与PA的结合基序,作者将目光聚焦到一个金属依赖的磷酸二酯酶(MdPDE1)。通过体外酶活验证、体内功能验证表明,MdPDE1可感知DGK7产生的PA信号,与PA结合降解cAMP,从而将脂质信号转化为cAMP信号,最终赋予水稻耐热性。
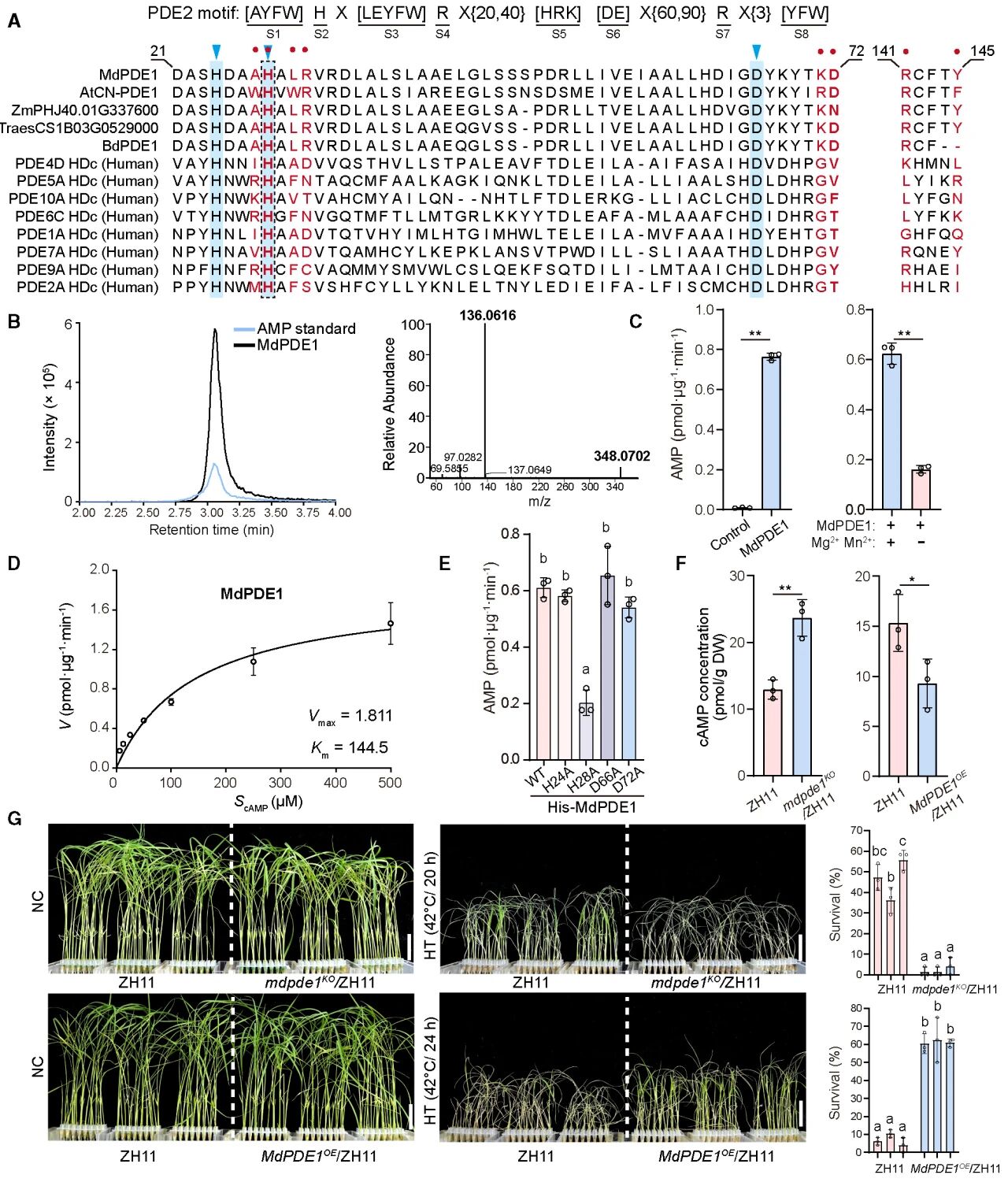 图8 MdPDE1具有PDE活性并赋予水稻耐热性
6. MdPDE1蛋白从细胞质到细胞核的转运过程受到TT2和DGK7的双重调控
研究表明,高温胁迫下富集于质膜的磷酸酯(PA)可通过DGK活性转位至细胞核中。因此,MdPDE1与PA的结合是否促进MdPDE1定位在细胞核内,从而调节热响应的下游cAMP信号?
通过本氏烟草叶片瞬时表达,发现正常温度下,MdPDE1主要定位于细胞质。当热胁迫处理15min后,MdPDE1迅速在细胞核内积累,并持续至少1h。破坏MdPDE1与PA结合会完全阻断其核转位过程,表明MdPDE1与PA结合是MdPDE1转移到细胞核的前提。DGK7通过催化DAG生成PA,为MdPDE1提供核转位信号,当DGK7磷酸化后,可显著促进MdPDE1核转位,而去磷酸化后,促进效果消失,表明DGK7激酶活性是调控MdPDE1核转位的关键。当DGK7激酶活性被TT2抑制时,会减少PA生成,进而降低PA与MdPDE1的结合,减弱核转位过程。因此,整体结果表明:热胁迫下,TT2低表达可增强DGK7的激酶活性,促进DGK7将DAG转化为PA,进而增加PA与MdPDE1的结合,促进MdPDE1入核并在核内降低cAMP表达,以实现植物耐热。
图8 MdPDE1具有PDE活性并赋予水稻耐热性
6. MdPDE1蛋白从细胞质到细胞核的转运过程受到TT2和DGK7的双重调控
研究表明,高温胁迫下富集于质膜的磷酸酯(PA)可通过DGK活性转位至细胞核中。因此,MdPDE1与PA的结合是否促进MdPDE1定位在细胞核内,从而调节热响应的下游cAMP信号?
通过本氏烟草叶片瞬时表达,发现正常温度下,MdPDE1主要定位于细胞质。当热胁迫处理15min后,MdPDE1迅速在细胞核内积累,并持续至少1h。破坏MdPDE1与PA结合会完全阻断其核转位过程,表明MdPDE1与PA结合是MdPDE1转移到细胞核的前提。DGK7通过催化DAG生成PA,为MdPDE1提供核转位信号,当DGK7磷酸化后,可显著促进MdPDE1核转位,而去磷酸化后,促进效果消失,表明DGK7激酶活性是调控MdPDE1核转位的关键。当DGK7激酶活性被TT2抑制时,会减少PA生成,进而降低PA与MdPDE1的结合,减弱核转位过程。因此,整体结果表明:热胁迫下,TT2低表达可增强DGK7的激酶活性,促进DGK7将DAG转化为PA,进而增加PA与MdPDE1的结合,促进MdPDE1入核并在核内降低cAMP表达,以实现植物耐热。
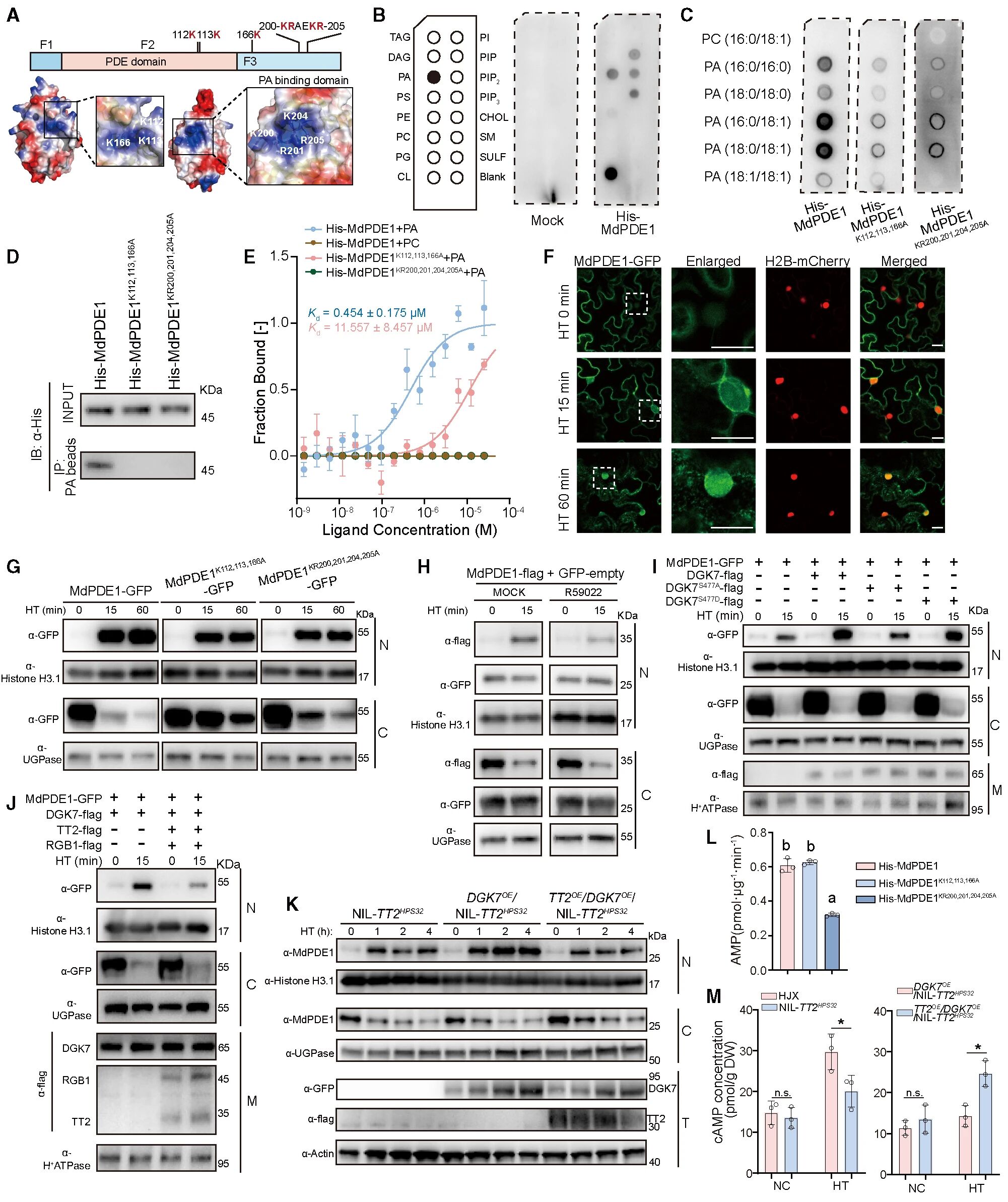 图9 MdPDE1需要与PA结合才可发生核转位过程
7. MdPDE1通过调控cAMP信号通路维持热胁迫下的活性氧(ROS)稳态
上文已证实MdPDE1降解cAMP赋予水稻耐热性,但cAMP如何转化为生理响应尚不清楚。基于ROS是热胁迫的主要影响过程。作者提出假设:MdPDE1是否通过调控cAMP信号来维持ROS稳态?
构建MdPDE1缺失突变体(mdpde1,cAMP升高)和过表达(MdPDE1,cAMP降低)水稻株系,野生型对照,高温和正常条件处理,观察株系的存活率、植物形态、组织化学染色、氧化损伤量等指标,发现mdpde1可增加ROS积累,降低水稻耐热性。分析mdpde1-vs-野生型在高温和正常条件下的转录组数据,发现mdpde1中抗氧化基因下调,表明cAMP可负调控ROS防御。随后结合qPCR、Western blot、遗传互作等实验证实核内cAMP降低可激活核内转录过程,上调ROS清除基因,进而降低核内ROS积累,避免热胁迫下细胞核内ROS的积累和耐热性降低。
图9 MdPDE1需要与PA结合才可发生核转位过程
7. MdPDE1通过调控cAMP信号通路维持热胁迫下的活性氧(ROS)稳态
上文已证实MdPDE1降解cAMP赋予水稻耐热性,但cAMP如何转化为生理响应尚不清楚。基于ROS是热胁迫的主要影响过程。作者提出假设:MdPDE1是否通过调控cAMP信号来维持ROS稳态?
构建MdPDE1缺失突变体(mdpde1,cAMP升高)和过表达(MdPDE1,cAMP降低)水稻株系,野生型对照,高温和正常条件处理,观察株系的存活率、植物形态、组织化学染色、氧化损伤量等指标,发现mdpde1可增加ROS积累,降低水稻耐热性。分析mdpde1-vs-野生型在高温和正常条件下的转录组数据,发现mdpde1中抗氧化基因下调,表明cAMP可负调控ROS防御。随后结合qPCR、Western blot、遗传互作等实验证实核内cAMP降低可激活核内转录过程,上调ROS清除基因,进而降低核内ROS积累,避免热胁迫下细胞核内ROS的积累和耐热性降低。
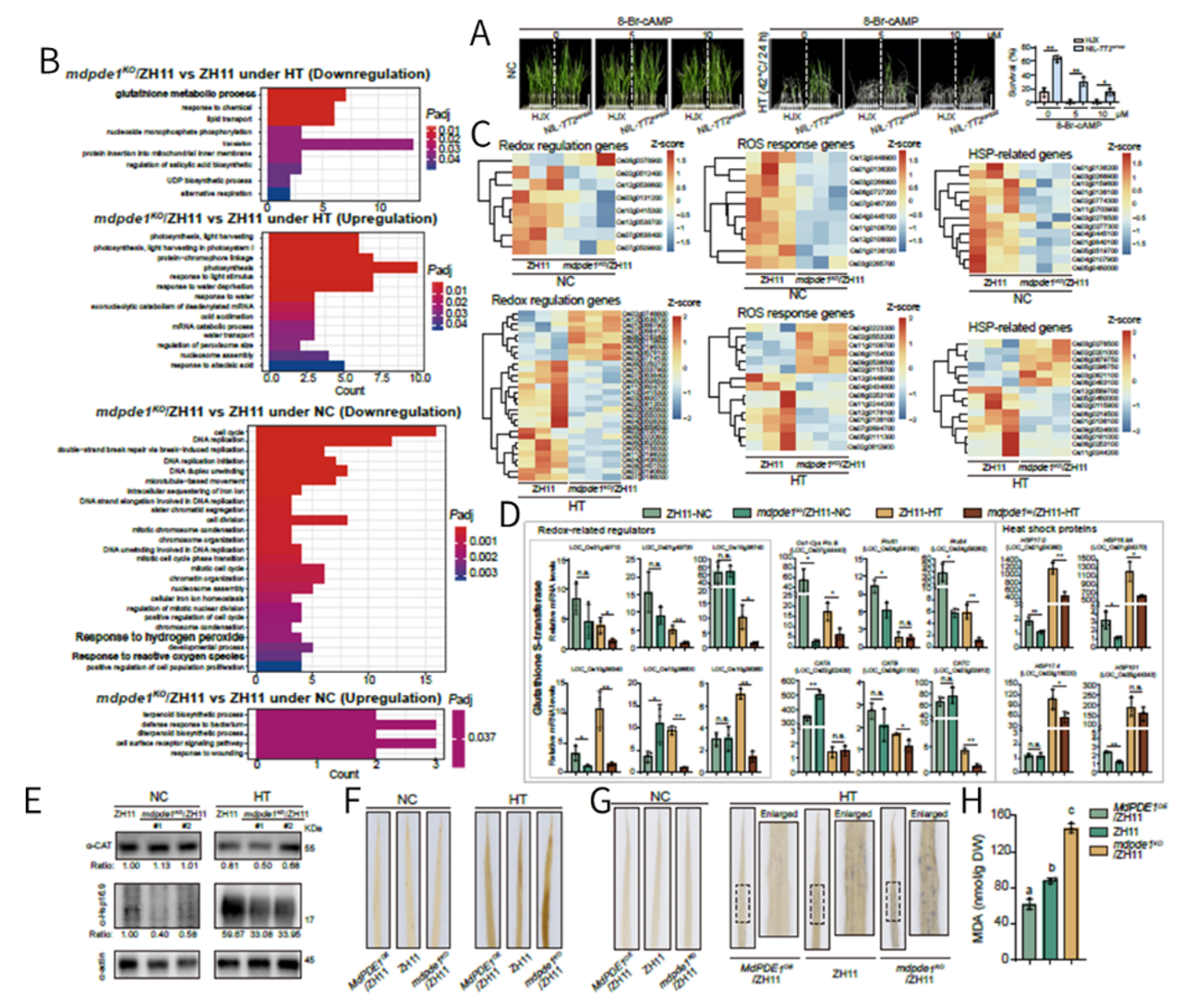 图10 MdPDE1核易位通过维持ROS稳态而增强耐热性
8. 从理论到田间:设计“梯度耐热”新品种
在揭示了水稻耐热分子机制(TT2低表达→DGK7激酶活性增加→PA增加→MdPDE1积累→cAMP下降→耐热性增加)后,能否通过遗传改造信号模块,在田间条件下培养出具有不同耐热等级且无产量代谢的作物品种?
采用单基因过表达和多基因组合两种策略创制4类转基因水稻株系:DGK7过表达系(DGK7OE/HJX、DGK7OE/ NIL-TT2HPS32)、MdPDE1过表达系(MdPDE1OE/ZH11、MdPDE1OE/NIL-TT2HPS32)、TT2/DGK7双过表达株系、野生型株系(HJX、NIL-TT2HPS32、ZH11)。在整个生殖发育阶段热胁迫处理4类转基因水稻株系,通过分析植物形态、产量、花粉活力、籽粒品质等指标,发现所有转基因系在正常条件下无产量损失,株型无异常。同时,单基因突变株系如:过表达DGK7或MdPDE1,可在轻度热害频发地使用,不影响株型和基础产量。DGK7过表达叠加TT2缺失的增产效果最佳,可增产108.67%,远高于单基因突变株系,适用于极端高温频发,粮食安全高风险区域。
图10 MdPDE1核易位通过维持ROS稳态而增强耐热性
8. 从理论到田间:设计“梯度耐热”新品种
在揭示了水稻耐热分子机制(TT2低表达→DGK7激酶活性增加→PA增加→MdPDE1积累→cAMP下降→耐热性增加)后,能否通过遗传改造信号模块,在田间条件下培养出具有不同耐热等级且无产量代谢的作物品种?
采用单基因过表达和多基因组合两种策略创制4类转基因水稻株系:DGK7过表达系(DGK7OE/HJX、DGK7OE/ NIL-TT2HPS32)、MdPDE1过表达系(MdPDE1OE/ZH11、MdPDE1OE/NIL-TT2HPS32)、TT2/DGK7双过表达株系、野生型株系(HJX、NIL-TT2HPS32、ZH11)。在整个生殖发育阶段热胁迫处理4类转基因水稻株系,通过分析植物形态、产量、花粉活力、籽粒品质等指标,发现所有转基因系在正常条件下无产量损失,株型无异常。同时,单基因突变株系如:过表达DGK7或MdPDE1,可在轻度热害频发地使用,不影响株型和基础产量。DGK7过表达叠加TT2缺失的增产效果最佳,可增产108.67%,远高于单基因突变株系,适用于极端高温频发,粮食安全高风险区域。

本文闪亮点
创新性:首次在植物中揭示了脂质信号→核cAMP→ROS稳态的三级信号链,将上游物理信号(热胁迫)与下游生理响应(抗氧化)通过第二信使串联;
完整性:从分子酶活→亚细胞定位→转录调控→生理表型层层递进,结合遗传学、生化、组学(转录组+脂质组+修饰蛋白位点鉴定)多维度证据,构成完整证据链;
田间价值:该研究构建的突变体系可应用于大田环境,实现不牺牲品种原有高产潜力的前提下,提升水稻的耐热性。还可根据不同生态区和生产需求灵活组合,实现“按需定制”的耐热作物设计,使作物耐热性成为可编辑、可预测、可定制的性状,为全球变暖下的粮食生产提供分子级的解决方案。
中科优品推荐 【中科新生命】的多组学服务业务可为各位研究者提供详细的“实验设计、样本检测、生信分析、数据解读与挖掘”等工作,为您深入进行科学研究,发表高分文章,为后续临床转化奠定基础。
关于中科新生命
上海中科新生命生物科技有限公司(APTBIO)创立于 2004 年,由原中国科学院上海生命科学研究院蛋白质组研究中心孵化而来,是国内质谱多组学应用领域的开拓者。公司以 “AI + 质谱多组学” 双核驱动创新,构建智能化组学生态。拥有自主知识产权的质谱检测平台与 AI 大数据分析系统,聚焦科技服务、生物医药及大健康消费三大领域,为全球科研机构、医院、药企提供从基础研究到临床转化的一站式解决方案。融合多组学技术与人工智能,围绕生物标志物发掘、药物靶点筛选及个性化诊疗等方向,构建具有国际竞争力的组学数据库与算法模型,推动转化医学进程,加速创新药物研发,成为推动生命科学数字化升级的核心引领者。