上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Cancer cell | 张泽民院士领衔!揭秘直肠癌新辅助治疗如何特异性重塑T细胞和内皮细胞
162 人阅读发布时间:2025-12-29 16:45
 直肠癌在结直肠癌(CRC)的病例总数和死亡人数中占比均超过1/3,其发病率在全球排名第三,死亡率排名第二。局部晚期直肠癌(LARC)定义为II/III期,或T3/T4期的原发肿瘤或淋巴结转移,推荐治疗策略包括全新辅助治疗、新辅助化疗(nCT)和新辅助放疗(nRT)。全新辅助治疗能够提高病理完全缓解(pCR)率、减少远处转移并改善生存结果。全新辅助治疗成为LARC的标准疗法,但其疗效背后的免疫重塑机制尚不明确。
2025年11月,重庆医科大学/北京大学张泽民院士、中山大学肿瘤防治中心丁培荣主任、北京大学朱琳楠副研究员、重庆医科大学程斯进教授及高千千教授等合作团队在Cancer Cell(IF44.5)上发表题为“Remodeling of T and endothelial cells during total neoadjuvant therapy in rectal cancer”的研究性文章。该研究通过scRNA-seq、scTCR-seq和空间转录组对治疗前后配对的样本进行分析,描绘了不同新辅助疗法诱导的肿瘤微环境(TME)动态变化,揭示新辅助治疗后肿瘤微环境的重塑机制,并为LARC治疗反应的免疫基础提供了机制见解。
直肠癌在结直肠癌(CRC)的病例总数和死亡人数中占比均超过1/3,其发病率在全球排名第三,死亡率排名第二。局部晚期直肠癌(LARC)定义为II/III期,或T3/T4期的原发肿瘤或淋巴结转移,推荐治疗策略包括全新辅助治疗、新辅助化疗(nCT)和新辅助放疗(nRT)。全新辅助治疗能够提高病理完全缓解(pCR)率、减少远处转移并改善生存结果。全新辅助治疗成为LARC的标准疗法,但其疗效背后的免疫重塑机制尚不明确。
2025年11月,重庆医科大学/北京大学张泽民院士、中山大学肿瘤防治中心丁培荣主任、北京大学朱琳楠副研究员、重庆医科大学程斯进教授及高千千教授等合作团队在Cancer Cell(IF44.5)上发表题为“Remodeling of T and endothelial cells during total neoadjuvant therapy in rectal cancer”的研究性文章。该研究通过scRNA-seq、scTCR-seq和空间转录组对治疗前后配对的样本进行分析,描绘了不同新辅助疗法诱导的肿瘤微环境(TME)动态变化,揭示新辅助治疗后肿瘤微环境的重塑机制,并为LARC治疗反应的免疫基础提供了机制见解。

研究材料
26名LARC患者92个样本(包括44个血液样本和48个肿瘤组织样本)研究步骤
步骤1:新辅助放化疗后LARC肿瘤微环境中的细胞组成分析;
步骤2:LARC TME细胞类型组成由不同的新辅助疗法调控;
步骤3:IFNG+CD8+Tem频率及IFNG信号预测LARC患者全新辅助治疗治疗效果;
步骤4:肿瘤浸润的IFNG+CD8+Tem细胞可能是由内皮细胞从外周血中招募而来;
步骤5:CD8+T细胞与内皮细胞之间可能存在相互调节作用;
研究结果
1. 新辅助放化疗后LARC肿瘤微环境中的细胞组成
26名LARC患者接受nCT和全新辅助治疗治疗,发现nCT治疗的患者有62%病情稳定,38%达到部分缓解(PR),而全新辅助治疗治疗的患者73%达到部分缓解(PR),27%达到完全缓解(CR)。在新辅助治疗前(Pre)和治疗后(Post)的92个配对样本进行scRNA-seq和配对的scTCR-seq,得到19种细胞大类。新辅助治疗(尤其全新辅助治疗)后,恶性细胞数量下降,基质细胞数量增加,免疫细胞的变化呈现出更为复杂的模式,单核细胞、巨噬细胞的占比均有所增加,而B细胞数量下降,nRT后CD8+T细胞占比降低,Tregs增加,不同于全新辅助治疗组变化。通过scTCR-seq数据,分析新辅助治疗中扩增两个主要的Treg,即CD4-Treg-TNFRSF9和CD4-Treg-KLRB1,在nRT后扩增,但在nCT和全新辅助治疗后则减少,表明辐射后Treg的克隆扩增可能会在后续化疗后减少。配对样本中,CD8/Treg(CD4-Treg-TNFRSF9)值在nRT后降低,而全新辅助治疗后上升。综上,不同的新辅助治疗方式会显著重塑LARC的TME,而全新辅助治疗治疗可提高CD8/Treg的比值。
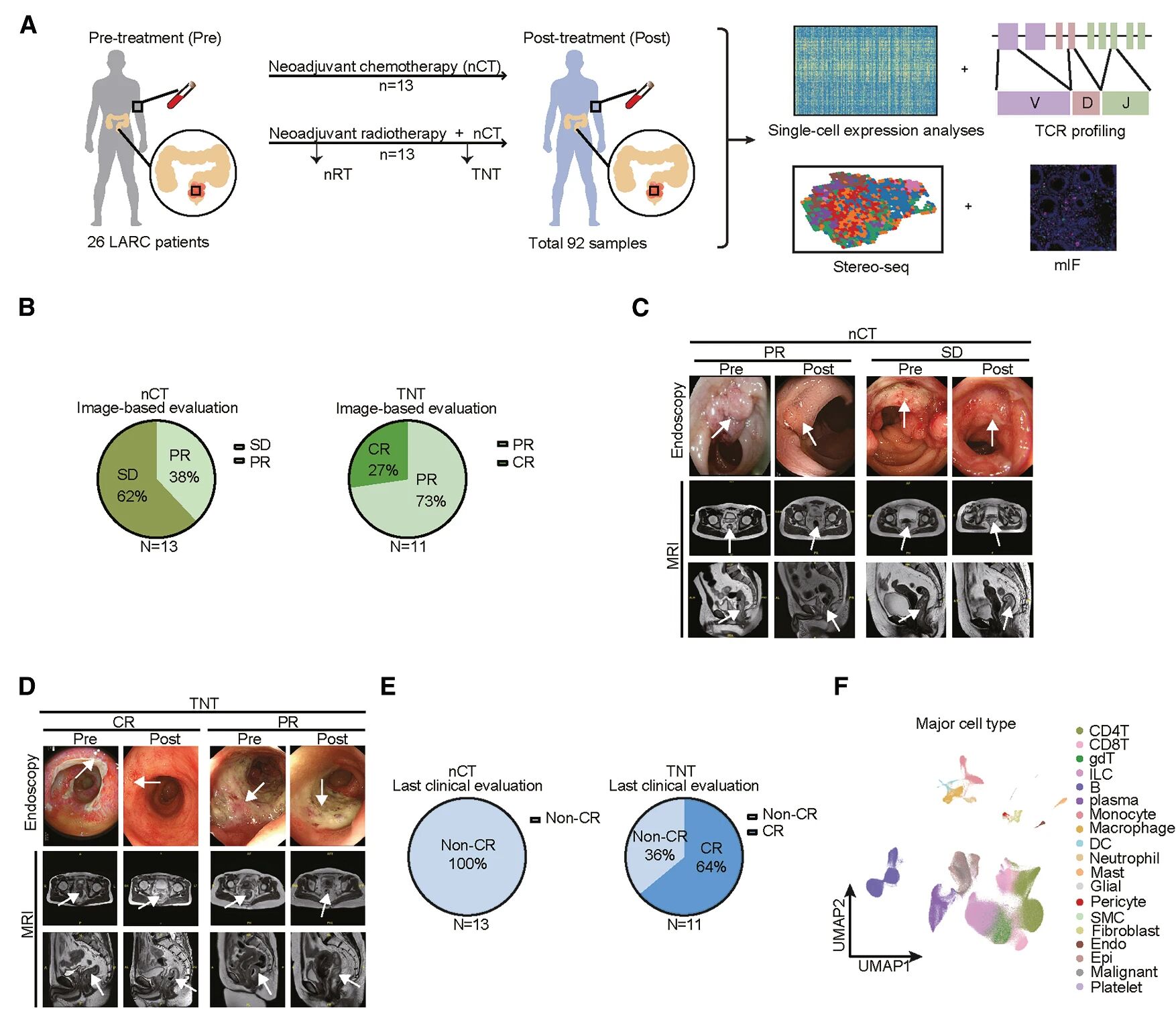 图1 LARC患者接受不同的新辅助治疗
图1 LARC患者接受不同的新辅助治疗
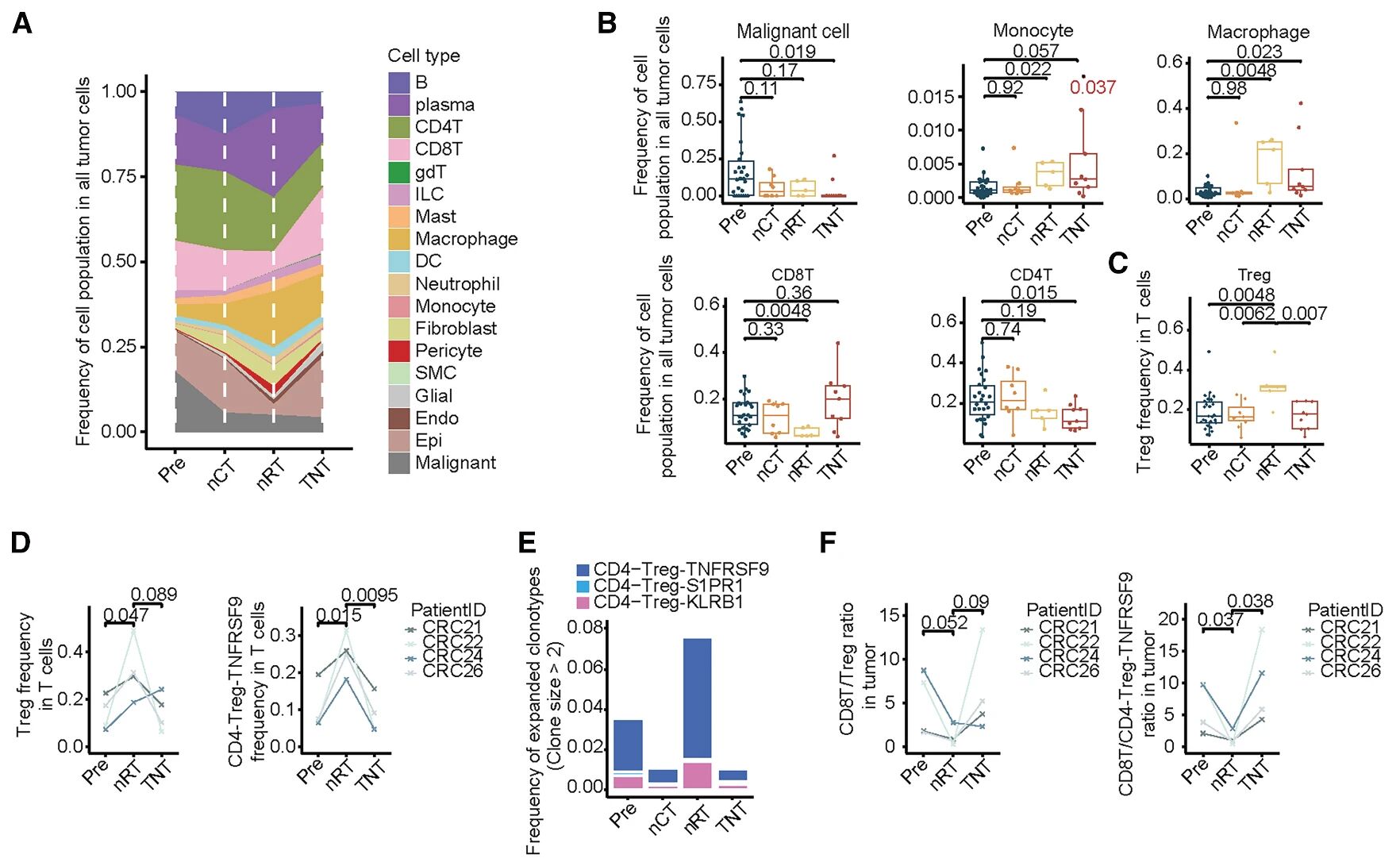 图2 LARC TME细胞类型组成由不同的新辅助疗法调控
2. 新辅助治疗在细胞模块水平重塑LARC TME
Pre样本富集增殖性T细胞、耗竭CD8-Tex-CXCL13及Treg,nCT和nRT样本表现出不同的细胞亚群分布,而全新辅助治疗具有两者共有的特征,也表现出独特的特性。划分七个具有独特组成特征的细胞模块(CM1至CM7),nCT后,TLS相关的CM3模块在增强,且与患者生存率呈正相关,而效应细胞和促炎模块CM2则减弱。空间转录组进一步支持nCT后TLS的增强,相比之下,nRT后CM3、CM1模块丰度下降,而CM2模块丰度增加,此外,在nRT和全新辅助治疗后CM6丰度显著降低,但在nCT后保持稳定。综上所述,不同的新辅助治疗方案显著重塑了LARC的肿瘤微环境。
图2 LARC TME细胞类型组成由不同的新辅助疗法调控
2. 新辅助治疗在细胞模块水平重塑LARC TME
Pre样本富集增殖性T细胞、耗竭CD8-Tex-CXCL13及Treg,nCT和nRT样本表现出不同的细胞亚群分布,而全新辅助治疗具有两者共有的特征,也表现出独特的特性。划分七个具有独特组成特征的细胞模块(CM1至CM7),nCT后,TLS相关的CM3模块在增强,且与患者生存率呈正相关,而效应细胞和促炎模块CM2则减弱。空间转录组进一步支持nCT后TLS的增强,相比之下,nRT后CM3、CM1模块丰度下降,而CM2模块丰度增加,此外,在nRT和全新辅助治疗后CM6丰度显著降低,但在nCT后保持稳定。综上所述,不同的新辅助治疗方案显著重塑了LARC的肿瘤微环境。
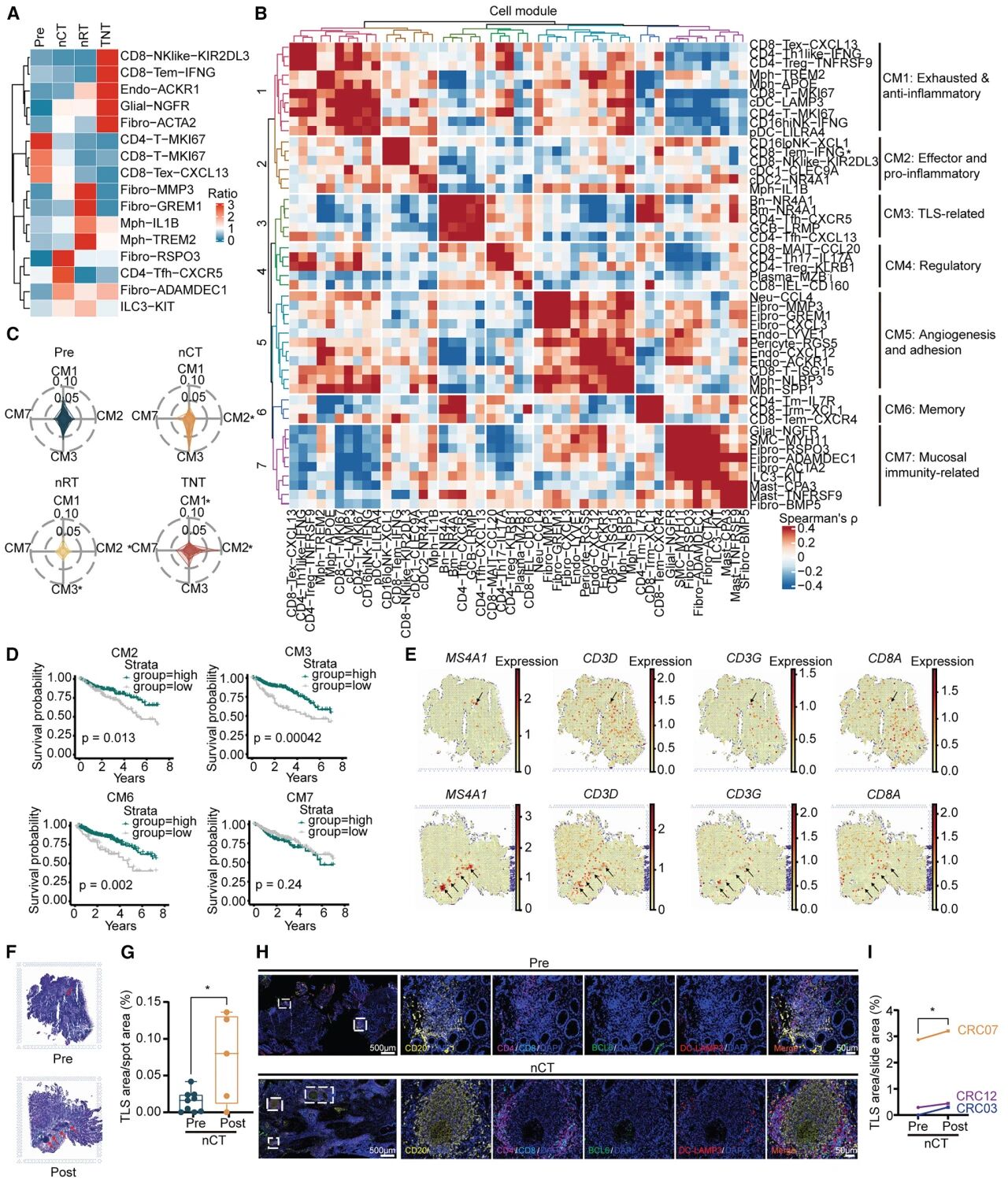 图3 新辅助放化疗在CM层面上重塑了LARC的TME
3. IFNG+CD8+Tem频率及IFNG信号预测LARC患者全新辅助治疗治疗效果
在nRT后,CD8-Tem-IFNG比例下降,而在全新辅助治疗后上升,其丰度与肿瘤缩小程度正相关,表明其具有潜在的抗肿瘤功能。IFNG+CD8+Tem细胞表现出高水平的IFNG和激活标志基因(CD69、GZMH、GZMK和HLA-DRA),表明其在抗肿瘤免疫中的效应作用。全新辅助治疗治疗后,CD8+T细胞中的IFNG表达显著升高,CR患者中升高更明显且达到峰值,表明肿瘤中的IFNG表达情况可作为LARC患者临床反应的生物标志物。
除了重塑TME外,全新辅助治疗似乎对全身免疫系统产生了影响,外周血淋巴细胞(PBL)的IFNG信号传导水平升高,ROC曲线表明,IFNG标志能够区分接受全新辅助治疗治疗后的CR患者和非CR患者。
图3 新辅助放化疗在CM层面上重塑了LARC的TME
3. IFNG+CD8+Tem频率及IFNG信号预测LARC患者全新辅助治疗治疗效果
在nRT后,CD8-Tem-IFNG比例下降,而在全新辅助治疗后上升,其丰度与肿瘤缩小程度正相关,表明其具有潜在的抗肿瘤功能。IFNG+CD8+Tem细胞表现出高水平的IFNG和激活标志基因(CD69、GZMH、GZMK和HLA-DRA),表明其在抗肿瘤免疫中的效应作用。全新辅助治疗治疗后,CD8+T细胞中的IFNG表达显著升高,CR患者中升高更明显且达到峰值,表明肿瘤中的IFNG表达情况可作为LARC患者临床反应的生物标志物。
除了重塑TME外,全新辅助治疗似乎对全身免疫系统产生了影响,外周血淋巴细胞(PBL)的IFNG信号传导水平升高,ROC曲线表明,IFNG标志能够区分接受全新辅助治疗治疗后的CR患者和非CR患者。
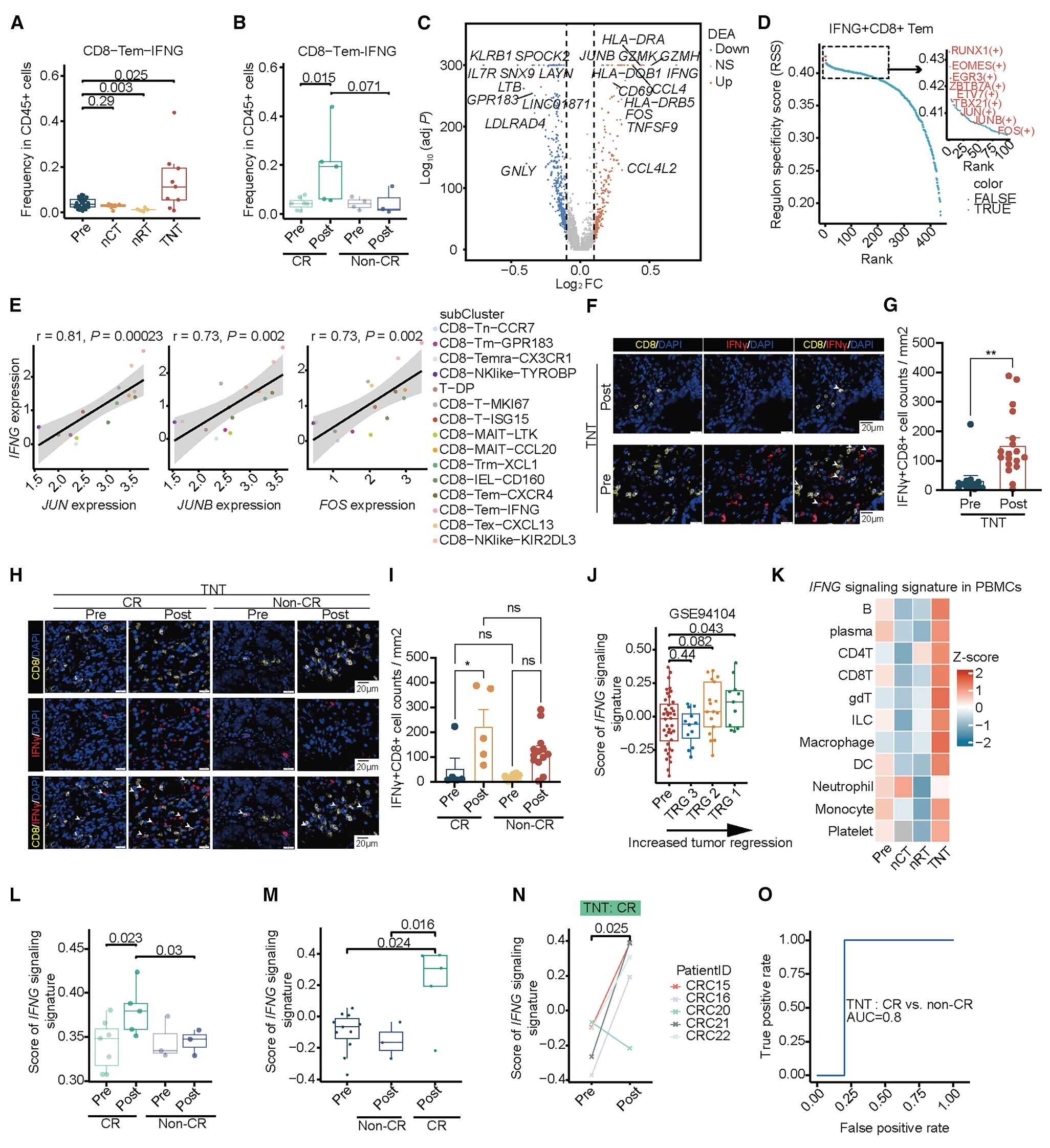 图4 IFNG+CD8+Tem频率及IFNG信号预测全新辅助治疗疗效
4. 肿瘤浸润的IFNG+CD8+Tem细胞可能是由内皮细胞从外周血中招募而来
在4名患者的Pre、nRT和全新辅助治疗配对样本中,发现nRT后下降的IFNG+CD8+Tem细胞在全新辅助治疗后恢复到更高水平,追溯其共享TCR亚群主要来源于血液中的CD8-Temra-CX3CR1、CD8-Tm-GPR183和CD8-NK-TYROBP。值得注意的是,全新辅助治疗后PBMC中CD8+T细胞与IFNG+CD8+Tem细胞共享TCR比nRT后数量更多,规模更大,表明肿瘤内这些克隆数量的增加是全新辅助治疗治疗后循环T细胞招募所致。
内皮细胞数量在nRT后上升,在全新辅助治疗后进一步上升,其丰度与IFNG+CD8+Tem正相关。受体-配体分析显示,ACKR1+内皮细胞与IFNG+CD8+Tem细胞的互作最强,且在全新辅助治疗治疗后特异性增加,表明ACKR1+内皮细胞招募T细胞的潜力最大,在空间转录组和免疫荧光实验中证实,即ACKR1+内皮细胞——可能在招募CD8+T细胞方面发挥关键作用。
图4 IFNG+CD8+Tem频率及IFNG信号预测全新辅助治疗疗效
4. 肿瘤浸润的IFNG+CD8+Tem细胞可能是由内皮细胞从外周血中招募而来
在4名患者的Pre、nRT和全新辅助治疗配对样本中,发现nRT后下降的IFNG+CD8+Tem细胞在全新辅助治疗后恢复到更高水平,追溯其共享TCR亚群主要来源于血液中的CD8-Temra-CX3CR1、CD8-Tm-GPR183和CD8-NK-TYROBP。值得注意的是,全新辅助治疗后PBMC中CD8+T细胞与IFNG+CD8+Tem细胞共享TCR比nRT后数量更多,规模更大,表明肿瘤内这些克隆数量的增加是全新辅助治疗治疗后循环T细胞招募所致。
内皮细胞数量在nRT后上升,在全新辅助治疗后进一步上升,其丰度与IFNG+CD8+Tem正相关。受体-配体分析显示,ACKR1+内皮细胞与IFNG+CD8+Tem细胞的互作最强,且在全新辅助治疗治疗后特异性增加,表明ACKR1+内皮细胞招募T细胞的潜力最大,在空间转录组和免疫荧光实验中证实,即ACKR1+内皮细胞——可能在招募CD8+T细胞方面发挥关键作用。
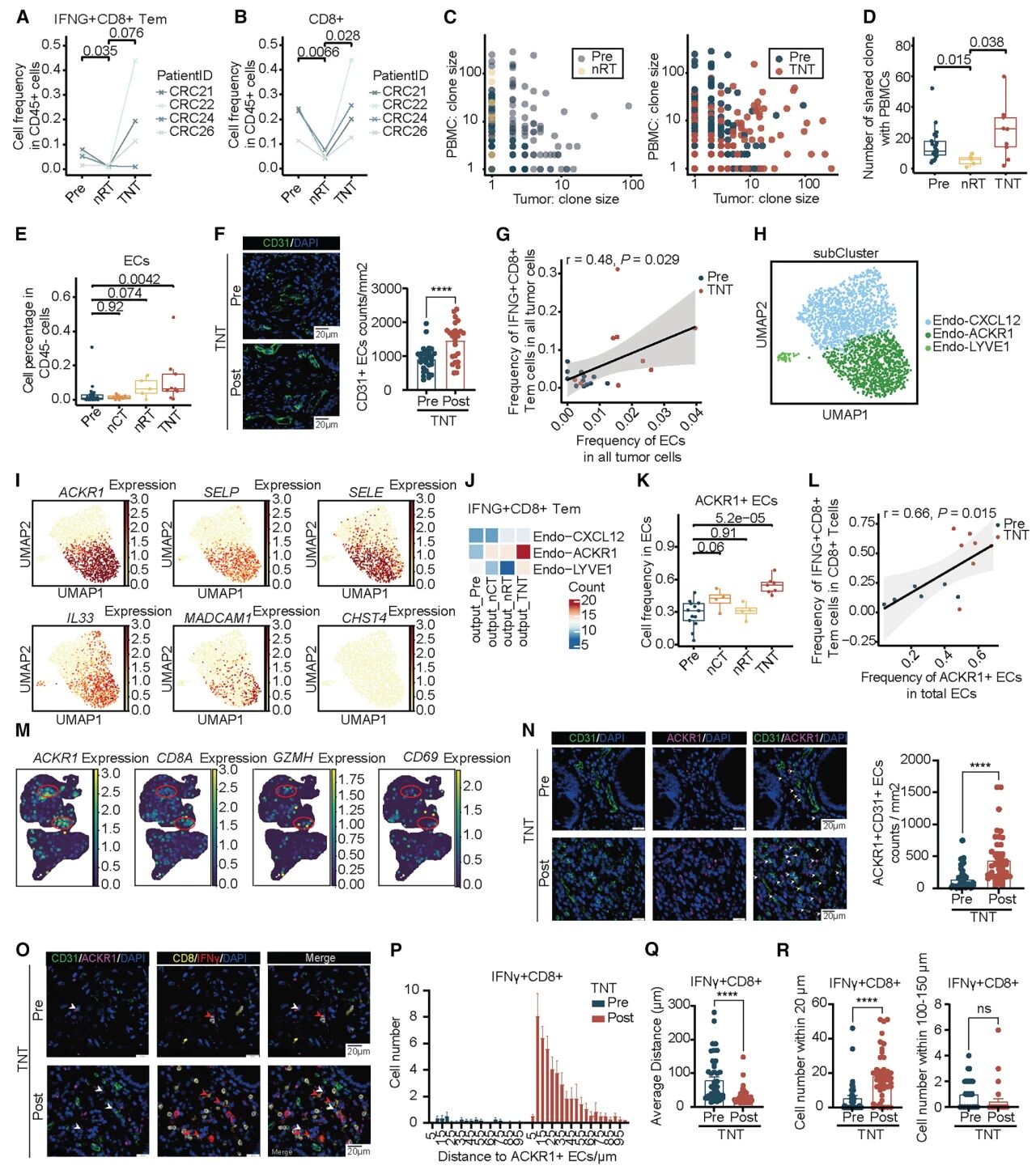 图5 肿瘤浸润的IFNG+CD8+Tem细胞可能通过ACKR1+ECs从PBL招募而来
5. CD8+T细胞与内皮细胞之间可能存在相互调节作用
全新辅助治疗处理后内皮细胞富集粘附相关、抗原呈递和T细胞激活通路,抗原呈递水平提高。内皮细胞中MHC-I/MHC-II基因、IFNG信号通路、IFNG和IFNGR1表达增强,且与CD8+T细胞中的IFNG表达呈正相关,表明IFNG-IFNGR1轴在CD8+T细胞-内皮细胞相互作用中可能有潜在作用。同时,在全新辅助治疗治疗后,内皮细胞出现增强的IFNG正反馈,且与IFNγ形成正反馈调节的IL33的表达显著增加,此外,IL33的表达与CD8+T细胞中的IFNG表达显著相关,暗示CD8+T细胞和内皮细胞之间可能存在相互影响。通过体外实验证明IFNγ能够增强人脐静脉内皮细胞中与抗原呈递相关的MHC表达,获得类似抗原呈递细胞(APC)的能力,能够激活CD8+T细胞。
图5 肿瘤浸润的IFNG+CD8+Tem细胞可能通过ACKR1+ECs从PBL招募而来
5. CD8+T细胞与内皮细胞之间可能存在相互调节作用
全新辅助治疗处理后内皮细胞富集粘附相关、抗原呈递和T细胞激活通路,抗原呈递水平提高。内皮细胞中MHC-I/MHC-II基因、IFNG信号通路、IFNG和IFNGR1表达增强,且与CD8+T细胞中的IFNG表达呈正相关,表明IFNG-IFNGR1轴在CD8+T细胞-内皮细胞相互作用中可能有潜在作用。同时,在全新辅助治疗治疗后,内皮细胞出现增强的IFNG正反馈,且与IFNγ形成正反馈调节的IL33的表达显著增加,此外,IL33的表达与CD8+T细胞中的IFNG表达显著相关,暗示CD8+T细胞和内皮细胞之间可能存在相互影响。通过体外实验证明IFNγ能够增强人脐静脉内皮细胞中与抗原呈递相关的MHC表达,获得类似抗原呈递细胞(APC)的能力,能够激活CD8+T细胞。
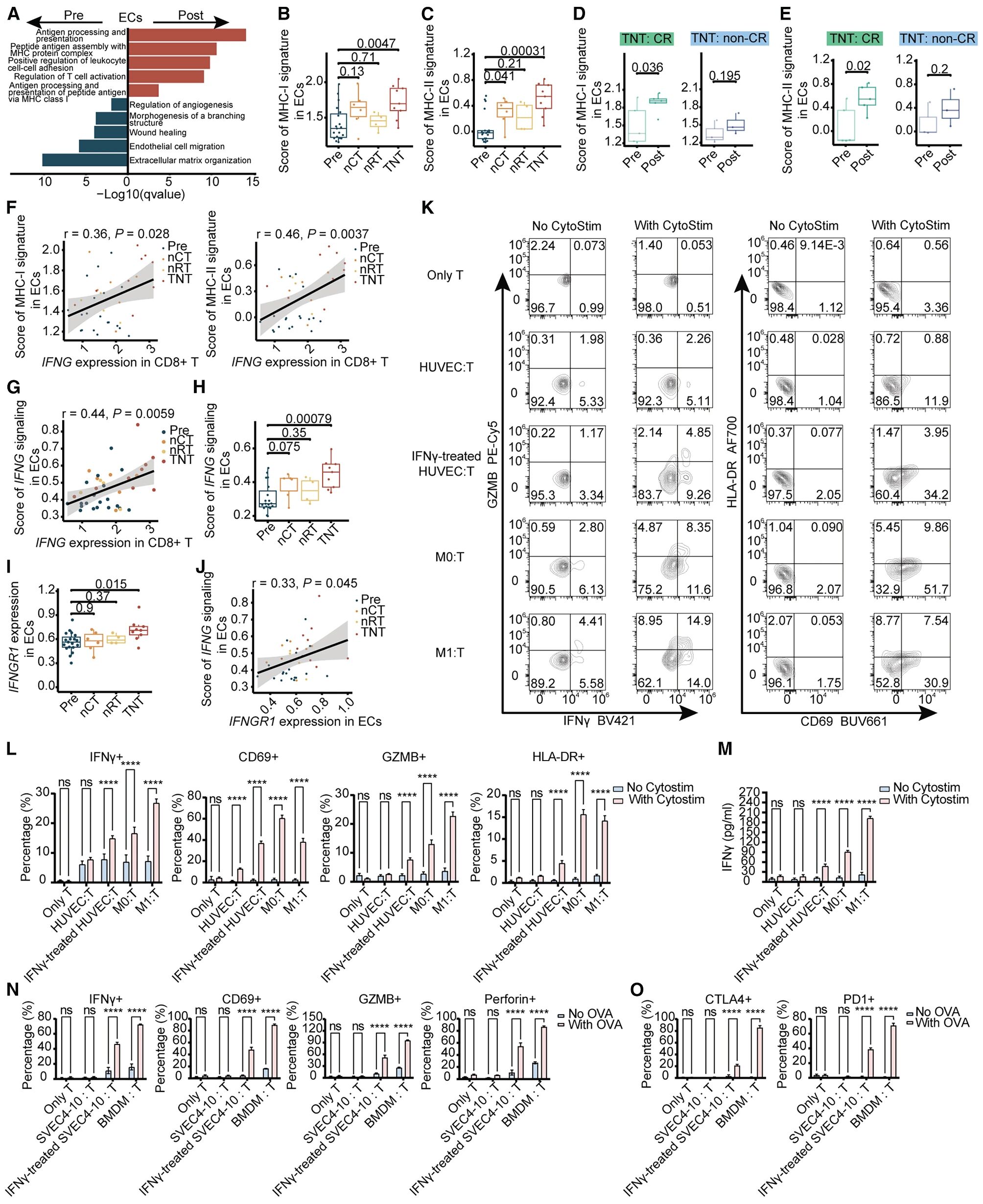 图6 由IFNγ刺激的内皮细胞可能在全新辅助治疗刺激下激活CD8+T细胞
图6 由IFNγ刺激的内皮细胞可能在全新辅助治疗刺激下激活CD8+T细胞
总结
该研究通过单细胞及空间转录组发现全新辅助治疗治疗后富集一群IFNG+CD8+Tem,揭示其与ACKR1+内皮细胞之间通过IFNG-IFNGR轴形成正反馈环路,增强内皮细胞的抗原呈递能力,从而共同促进了抗肿瘤免疫应答。综上,本研究系统描绘了新辅助治疗后的TME重塑,并为LARC治疗反应的免疫基础提供了独到的机制见解。中科优品推荐 【中科新生命】布局先进的10x Genomics、Visium CytAssist、MALDI 2、Astral等国际的时空多组学平台,提供单细胞空间多组学联合的一站式解决方案,包含单细胞测序类、单细胞蛋白组、空间转录组、空间蛋白组、深度空间代谢组、全息空间多组学以及常规转录、蛋白、代谢组检测,积累了丰富的项目经验,助力发表多篇高分文章,快来联系我们展开时空多组学联合实验吧!!!

关于中科新生命
上海中科新生命生物科技有限公司(APTBIO)创立于 2004 年,由原中国科学院上海生命科学研究院蛋白质组研究中心孵化而来,是国内质谱多组学应用领域的开拓者。公司以 “AI + 质谱多组学” 双核驱动创新,构建智能化组学生态。拥有自主知识产权的质谱检测平台与 AI 大数据分析系统,聚焦科技服务、生物医药及大健康消费三大领域,为全球科研机构、医院、药企提供从基础研究到临床转化的一站式解决方案。融合多组学技术与人工智能,围绕生物标志物发掘、药物靶点筛选及个性化诊疗等方向,构建具有国际竞争力的组学数据库与算法模型,推动转化医学进程,加速创新药物研发,成为推动生命科学数字化升级的核心引领者。