上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Nat Microbiol (IF20.5) | 养生界“顶流”益生菌也会“黑化”?清华大学发现ILC3可调节AKK菌增殖带来的病原体感染
504 人阅读发布时间:2025-05-21 15:34
 养生界的“顶流”——益生菌可以辅助调节肠道菌群、增强免疫力,然而研究发现益生菌也会“黑化”,大名鼎鼎的AKK菌就是潜在的“黑化头目”,AKK菌增殖会促进病原菌毒力因子表达,引爆感染危机。 2025年2月,清华大学郭晓欢团队在Nature Microbiology (IF 20.5)杂志上发表了题为“ILC3s regulate the gut microbiota via host intestinal galactosylation to limit pathogen infection in mice”的文章。文章发现ILC3缺乏导致肠道半乳糖基化增加,以及结肠粘液中共生Akkermansia muciniphila的扩增。A.muciniphila菌及其衍生代谢物琥珀酸盐的增加进一步促进了病原菌毒力因子tir和ler的表达,导致对C.rodentium菌的易感性增加。
养生界的“顶流”——益生菌可以辅助调节肠道菌群、增强免疫力,然而研究发现益生菌也会“黑化”,大名鼎鼎的AKK菌就是潜在的“黑化头目”,AKK菌增殖会促进病原菌毒力因子表达,引爆感染危机。 2025年2月,清华大学郭晓欢团队在Nature Microbiology (IF 20.5)杂志上发表了题为“ILC3s regulate the gut microbiota via host intestinal galactosylation to limit pathogen infection in mice”的文章。文章发现ILC3缺乏导致肠道半乳糖基化增加,以及结肠粘液中共生Akkermansia muciniphila的扩增。A.muciniphila菌及其衍生代谢物琥珀酸盐的增加进一步促进了病原菌毒力因子tir和ler的表达,导致对C.rodentium菌的易感性增加。

研究材料
小鼠粪便、肠道类器官
技术方法 16s多样性测序,qRCR检测,短链脂肪酸检测、非靶代谢检测、ELISA检测、流式细胞检测、类器官培养
技术路线 步骤1:在ILC3s缺陷小鼠中接种C.rodentium菌,发现A.muciniphila菌在肠菌中显著富集; 步骤2:C.rodentium菌和A.muciniphila菌共培养,发现A.muciniphila菌能提高C.rodentium菌的毒力; 步骤3:OMM11ΔA.m小鼠和体外培养的代谢物检测,发现A.muciniphila菌产生的琥珀酸盐会促进病原体感染; 步骤4:基于ILC3缺陷小鼠的结肠粘液成分以及肠道类器官培养,发现ILC3s通过调节半乳糖基化来控制A.muciniphila菌; 步骤5:肠道类器官培养和对ILC3缺陷小鼠补充IL-22后,发现LC3s产生IL-22并显著抑制类器官内的半乳糖基化。
研究结果 1. A.muciniphila菌聚集小鼠C.rodentium菌感染 为了研究ILC3s在肠道病原体定殖抗性中的具体作用,在ILC3s缺陷小鼠中接种C.rodentium菌,采用16SrRNA测序和qPCR技术分析了从定殖小鼠以及同窝对照小鼠中分离的结肠粘膜细菌。结果发现,以其对肥胖、2型糖尿病和癌症的有益作用而闻名的A.muciniphila在有感染的ILC3缺陷小鼠的结肠粘膜中更丰富。为了确定A.muciniphila菌是否有助于ILC3缺陷小鼠对C.rodentium感染的易感性增加,将野生型(WT)小鼠口服A.muciniphila菌,然后感染C.rodentium菌,发现A.muciniphila菌可以影响C.rodentium菌的早期定殖。且基于OMM11模型发现,相对于有A.muciniphila菌的小鼠而言,无A.muciniphila菌(OMM11ΔA.m)的小鼠在感染C.rodentium菌后定殖量更低。综上所述,A.muciniphila菌可以促进C.rodentium菌的定植并增加宿主对感染的易感性。
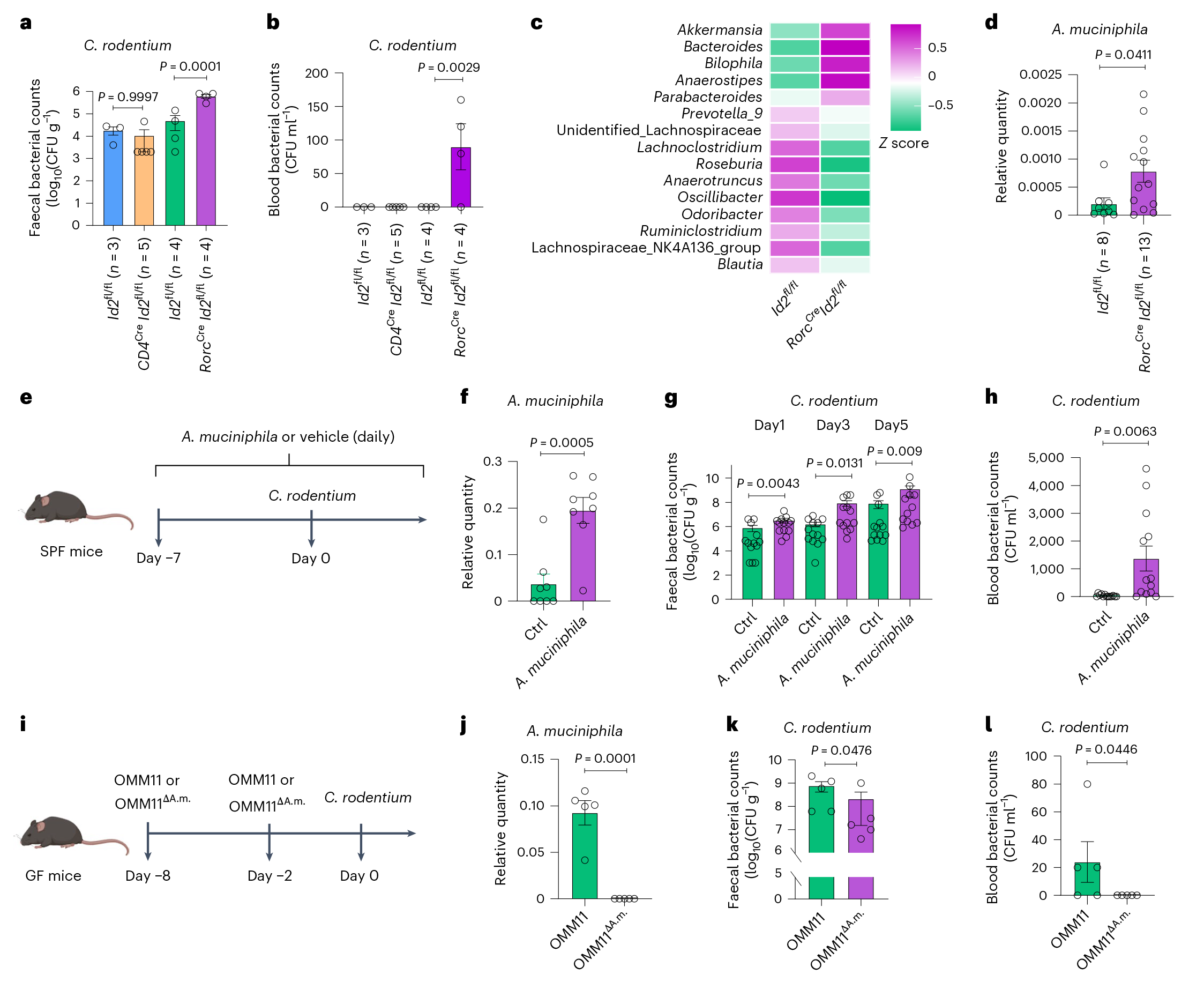 图1 A.muciniphila菌在ilc3缺陷小鼠体内的过度生长聚集了C.rodentium菌感染 2. A.muciniphila菌能提高C.rodentium的毒力 为了探究A.muciniphila菌如何影响宿主对C.rodentium菌感染的敏感性,在体外与C.rodentium菌共培养A.muciniphila菌,发现共培养下的C.rodentium菌显示出毒力因子tir和ler的增强表达。这些毒力因子控制着大多数肠细胞清除基因位点,用于附着和清除病原体,并在C.rodentium菌在宿主体内的定殖和入侵中发挥关键作用。同时,在体内A.muciniphila菌也增强了C.rodentium菌中tir和ler的表达,且OMM11ΔA.m小鼠中C.rodentium菌的tir和ler表达减少,伴随A.muciniphila菌在ILC3缺陷小鼠体内定殖的增加,也观察到C.rodentium菌的tir和ler的表达增强。即A.muciniphila菌会通过上调病原体的毒力来促进C.rodentium菌的定殖。
图1 A.muciniphila菌在ilc3缺陷小鼠体内的过度生长聚集了C.rodentium菌感染 2. A.muciniphila菌能提高C.rodentium的毒力 为了探究A.muciniphila菌如何影响宿主对C.rodentium菌感染的敏感性,在体外与C.rodentium菌共培养A.muciniphila菌,发现共培养下的C.rodentium菌显示出毒力因子tir和ler的增强表达。这些毒力因子控制着大多数肠细胞清除基因位点,用于附着和清除病原体,并在C.rodentium菌在宿主体内的定殖和入侵中发挥关键作用。同时,在体内A.muciniphila菌也增强了C.rodentium菌中tir和ler的表达,且OMM11ΔA.m小鼠中C.rodentium菌的tir和ler表达减少,伴随A.muciniphila菌在ILC3缺陷小鼠体内定殖的增加,也观察到C.rodentium菌的tir和ler的表达增强。即A.muciniphila菌会通过上调病原体的毒力来促进C.rodentium菌的定殖。
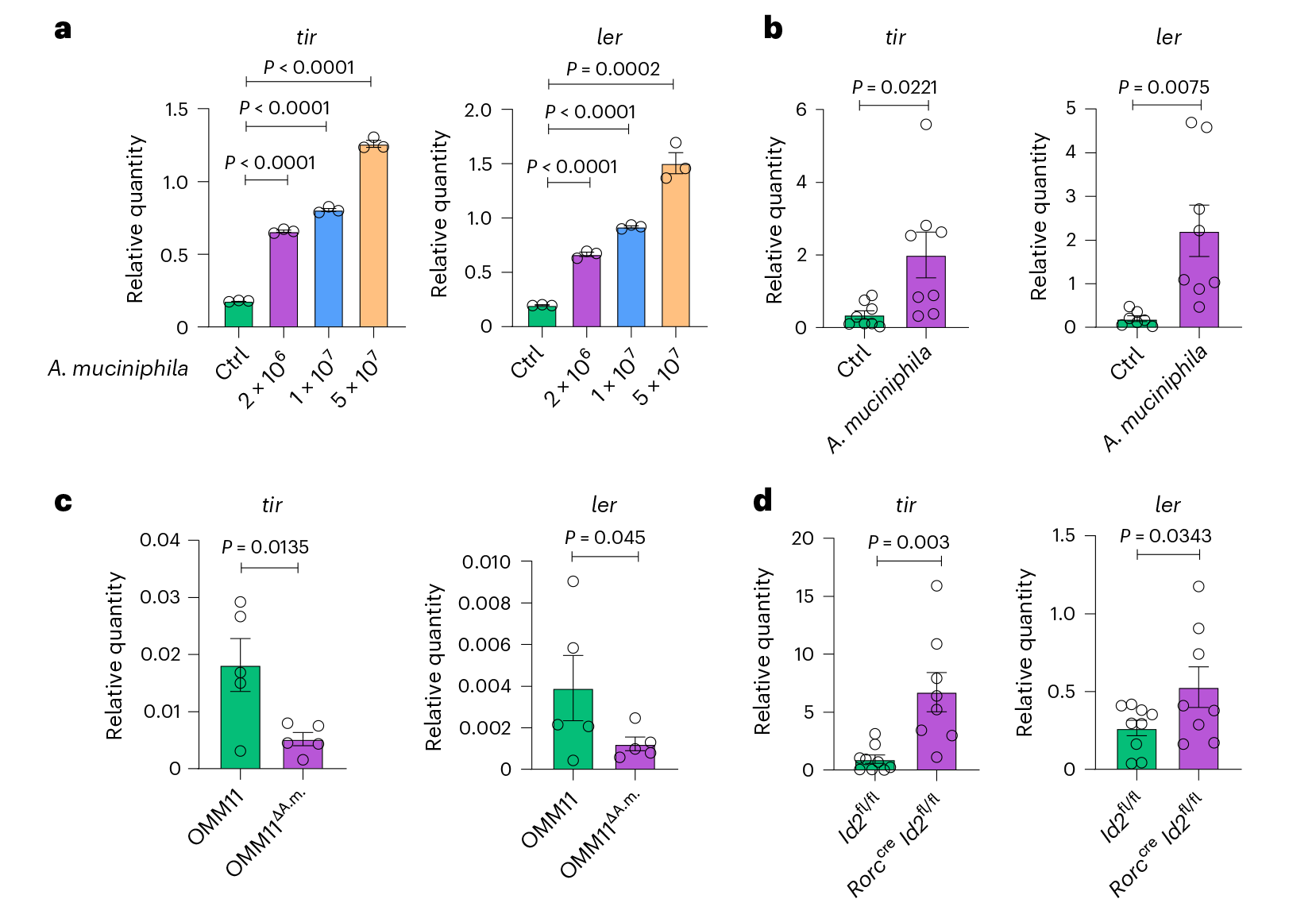 图2 A.muciniphila菌通过增强病原体的毒力来促进C.rodentium的感染 3. A.muciniphila产生的琥珀酸盐促进病原体感染 假设A.muciniphila菌衍生的代谢物是导致C.rodentium菌定殖和入侵增加的原因,为了确定哪些代谢物对A.muciniphila菌促进C.rodentium菌毒力至关重要,在有或没有A.muciniphila菌的培养基上进行了代谢组学分析。与对照组相比,在A.muciniphila菌培养的培养基中,乙酸盐、丙’酸盐和异戊酸盐等多种SCFA表现出显著的诱导作用,亲水性物质中有30种成分增加,20种成分减少,其中琥珀酸盐和甲基丙二酸VIP评分中具有最高。分别用乙酸、丙’酸、异戊酸、甲基丙二酸和琥珀酸进行培养发现琥珀酸盐和甲基丙二酸在体外增加了C.rodentium菌毒力因子tir和ler的表达,给WT小鼠饮用含有乙酸、丙’酸、甲基丙二酸或琥珀酸的水然后感染C.rodentium菌,与甲基丙二酸、丙’酸和醋酸盐相比,只有琥珀酸盐增加了C.rodentium菌的负担,并促进了病原体的全身传播。与OMM11ΔA.m小鼠相比OMM11小鼠盲肠内容物中的琥珀酸盐含量明显更高。
图2 A.muciniphila菌通过增强病原体的毒力来促进C.rodentium的感染 3. A.muciniphila产生的琥珀酸盐促进病原体感染 假设A.muciniphila菌衍生的代谢物是导致C.rodentium菌定殖和入侵增加的原因,为了确定哪些代谢物对A.muciniphila菌促进C.rodentium菌毒力至关重要,在有或没有A.muciniphila菌的培养基上进行了代谢组学分析。与对照组相比,在A.muciniphila菌培养的培养基中,乙酸盐、丙’酸盐和异戊酸盐等多种SCFA表现出显著的诱导作用,亲水性物质中有30种成分增加,20种成分减少,其中琥珀酸盐和甲基丙二酸VIP评分中具有最高。分别用乙酸、丙’酸、异戊酸、甲基丙二酸和琥珀酸进行培养发现琥珀酸盐和甲基丙二酸在体外增加了C.rodentium菌毒力因子tir和ler的表达,给WT小鼠饮用含有乙酸、丙’酸、甲基丙二酸或琥珀酸的水然后感染C.rodentium菌,与甲基丙二酸、丙’酸和醋酸盐相比,只有琥珀酸盐增加了C.rodentium菌的负担,并促进了病原体的全身传播。与OMM11ΔA.m小鼠相比OMM11小鼠盲肠内容物中的琥珀酸盐含量明显更高。
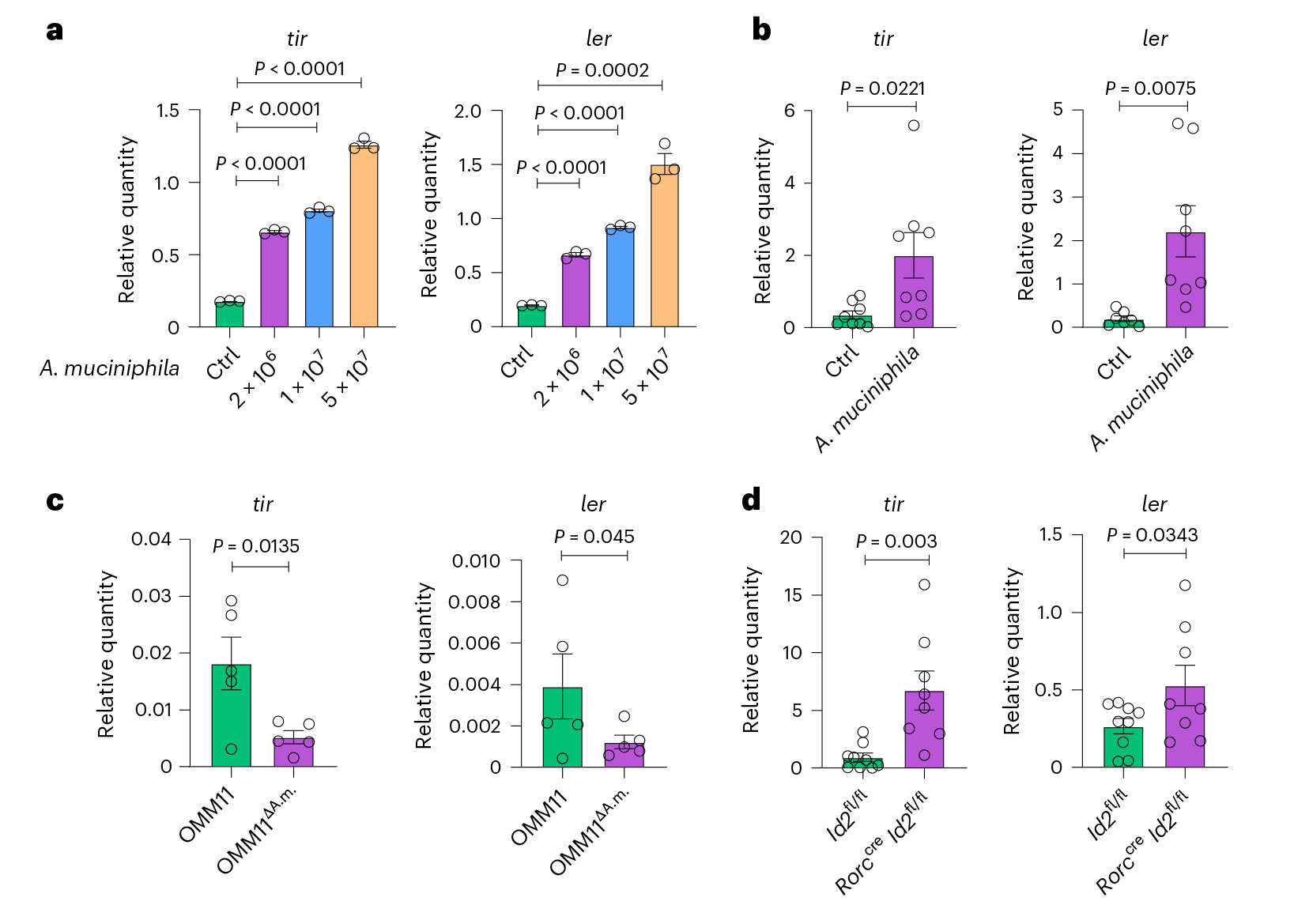 图3 A.muciniphila菌产生的琥珀酸盐可提高C.rodentium的毒力 为了进一步证实C.rodentium菌定殖和入侵依赖琥珀酸,用敲除DcuB转运体的菌株进行体外培养,发现琥珀酸盐在体外不能促进ΔDcuB C.rodentium菌的tir和ler表达,且A.muciniphila菌培养上清液不能促进ΔDcuB C.rodentium菌中tir和ler的表达。这表明A.muciniphila菌的代谢物以琥珀酸盐依赖的方式促进了C.rodentium菌的毒力。
图3 A.muciniphila菌产生的琥珀酸盐可提高C.rodentium的毒力 为了进一步证实C.rodentium菌定殖和入侵依赖琥珀酸,用敲除DcuB转运体的菌株进行体外培养,发现琥珀酸盐在体外不能促进ΔDcuB C.rodentium菌的tir和ler表达,且A.muciniphila菌培养上清液不能促进ΔDcuB C.rodentium菌中tir和ler的表达。这表明A.muciniphila菌的代谢物以琥珀酸盐依赖的方式促进了C.rodentium菌的毒力。
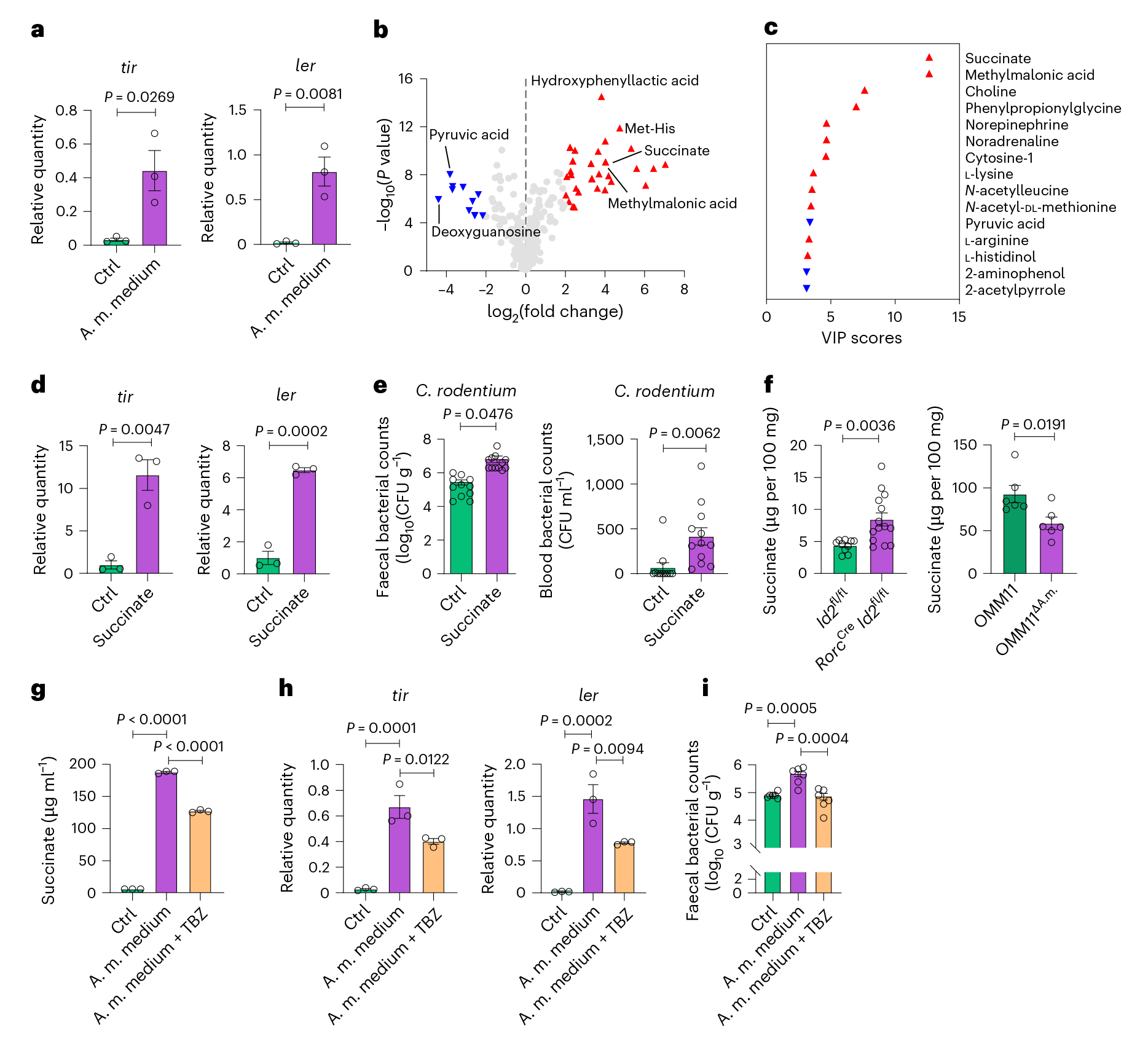 图4 琥珀酸盐是提高A.muciniphila对C.rodentium毒力的必需物质 4. ILC3s通过调节半乳糖基化来控制A.muciniphila菌 为了研究ILC3s如何调节细菌丰度,使用ILC3缺陷小鼠的结肠粘液培养A.muciniphila菌,发现ILC3缺陷小鼠的结肠粘液比来自对照小鼠的结肠粘液更有效地促进A.muciniphila菌的扩张,对粘液成分分析,发现黏液的主要成分是糖蛋白,且糖蛋白被广泛修饰,当ILC3缺陷的糖蛋白被特异性β1,3-半乳糖苷酶水解时,其支持A.muciniphila菌扩增的作用减弱。以及,喂食半乳糖的WT小鼠也显示出A.muciniphila菌增加,流式细胞术数据进一步支持与对照组相比,ILC3缺陷小鼠肠上皮细胞上的花生凝集素结合半乳糖基化增加。 使用肠道类器官与纯化的ILC3s共培养,并检测半乳糖基化,发现ILC3s抑制类器官内肠上皮半乳糖基化,在使用了半乳糖转移酶抑制剂后结肠上皮MC38细胞表面pna结合的半乳糖基化受抑制。综上ILC3s可能通过抑制半乳糖基化来阻止A.muciniphila菌在肠道中的扩张,从而维持肠道内稳态并介导定殖抗性。
图4 琥珀酸盐是提高A.muciniphila对C.rodentium毒力的必需物质 4. ILC3s通过调节半乳糖基化来控制A.muciniphila菌 为了研究ILC3s如何调节细菌丰度,使用ILC3缺陷小鼠的结肠粘液培养A.muciniphila菌,发现ILC3缺陷小鼠的结肠粘液比来自对照小鼠的结肠粘液更有效地促进A.muciniphila菌的扩张,对粘液成分分析,发现黏液的主要成分是糖蛋白,且糖蛋白被广泛修饰,当ILC3缺陷的糖蛋白被特异性β1,3-半乳糖苷酶水解时,其支持A.muciniphila菌扩增的作用减弱。以及,喂食半乳糖的WT小鼠也显示出A.muciniphila菌增加,流式细胞术数据进一步支持与对照组相比,ILC3缺陷小鼠肠上皮细胞上的花生凝集素结合半乳糖基化增加。 使用肠道类器官与纯化的ILC3s共培养,并检测半乳糖基化,发现ILC3s抑制类器官内肠上皮半乳糖基化,在使用了半乳糖转移酶抑制剂后结肠上皮MC38细胞表面pna结合的半乳糖基化受抑制。综上ILC3s可能通过抑制半乳糖基化来阻止A.muciniphila菌在肠道中的扩张,从而维持肠道内稳态并介导定殖抗性。
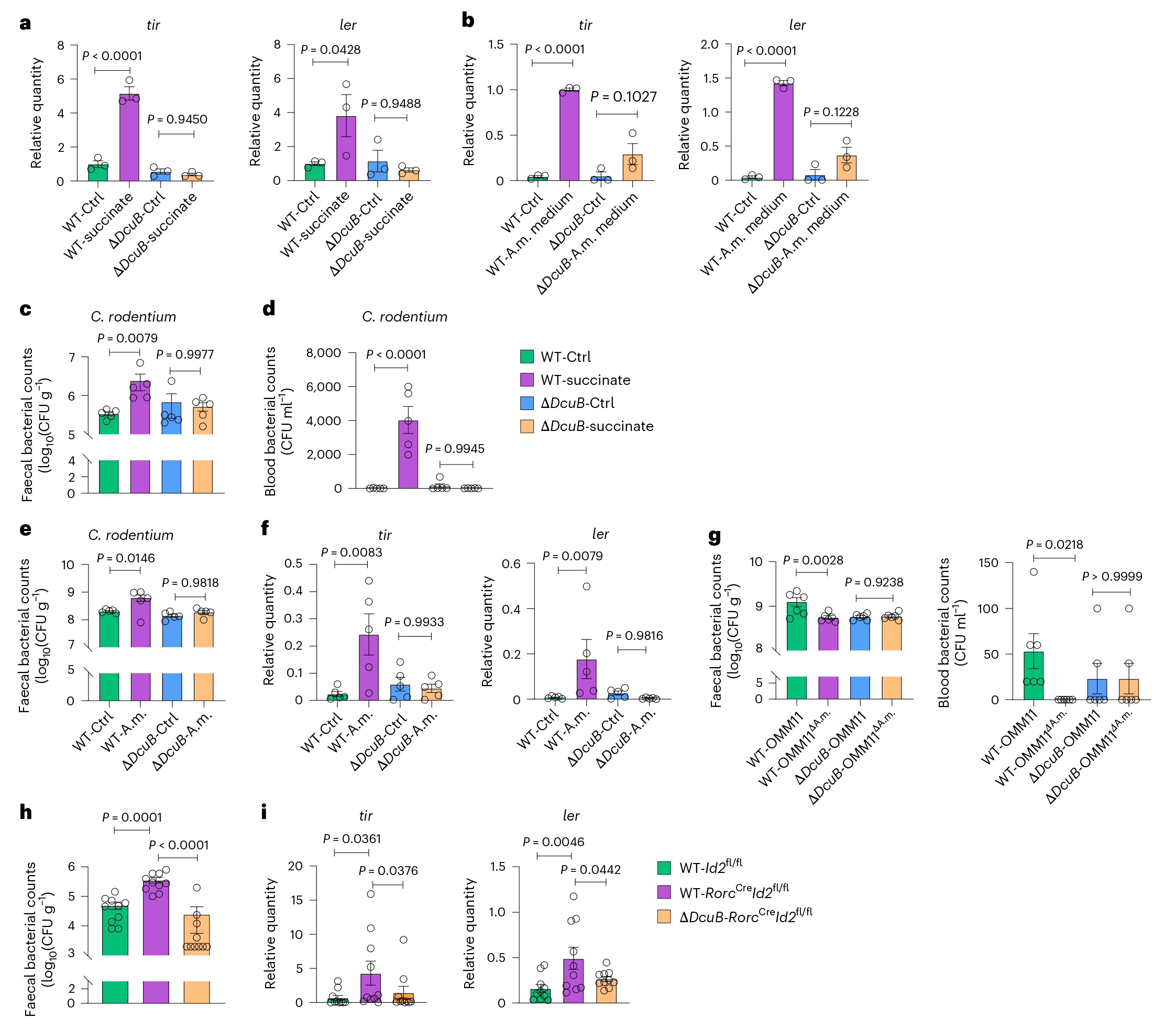 图5 ILC3s通过调节肠道半乳糖基化来限制嗜粘单胞杆菌的扩张 5. ILC3s通过IL-22抑制肠道半乳糖基化 前期研究已证明ILC3s通过IL-22依赖的肠道微生物调节来促进定殖抗性,为了确定IL-22是否也介导ILC3对肠道半乳糖基化的抑制,将肠道类器官与含或不含IL-22阻断抗体的ILC3共培养,发现LC3s产生IL-22并显著抑制类器官内的肠半乳糖基化,而IL-22阻断恢复肠上皮半乳糖基化。体内实验中,IL-22阻断提高了肠表面的半乳糖基化,同时增加了A.muciniphila菌在结肠黏膜的定殖和更高的C.rodentium菌负荷。且向ILC3缺陷小鼠补充IL-22可抑制肠道半乳糖基化,并伴有结肠黏膜A.muciniphila菌的减少。
图5 ILC3s通过调节肠道半乳糖基化来限制嗜粘单胞杆菌的扩张 5. ILC3s通过IL-22抑制肠道半乳糖基化 前期研究已证明ILC3s通过IL-22依赖的肠道微生物调节来促进定殖抗性,为了确定IL-22是否也介导ILC3对肠道半乳糖基化的抑制,将肠道类器官与含或不含IL-22阻断抗体的ILC3共培养,发现LC3s产生IL-22并显著抑制类器官内的肠半乳糖基化,而IL-22阻断恢复肠上皮半乳糖基化。体内实验中,IL-22阻断提高了肠表面的半乳糖基化,同时增加了A.muciniphila菌在结肠黏膜的定殖和更高的C.rodentium菌负荷。且向ILC3缺陷小鼠补充IL-22可抑制肠道半乳糖基化,并伴有结肠黏膜A.muciniphila菌的减少。
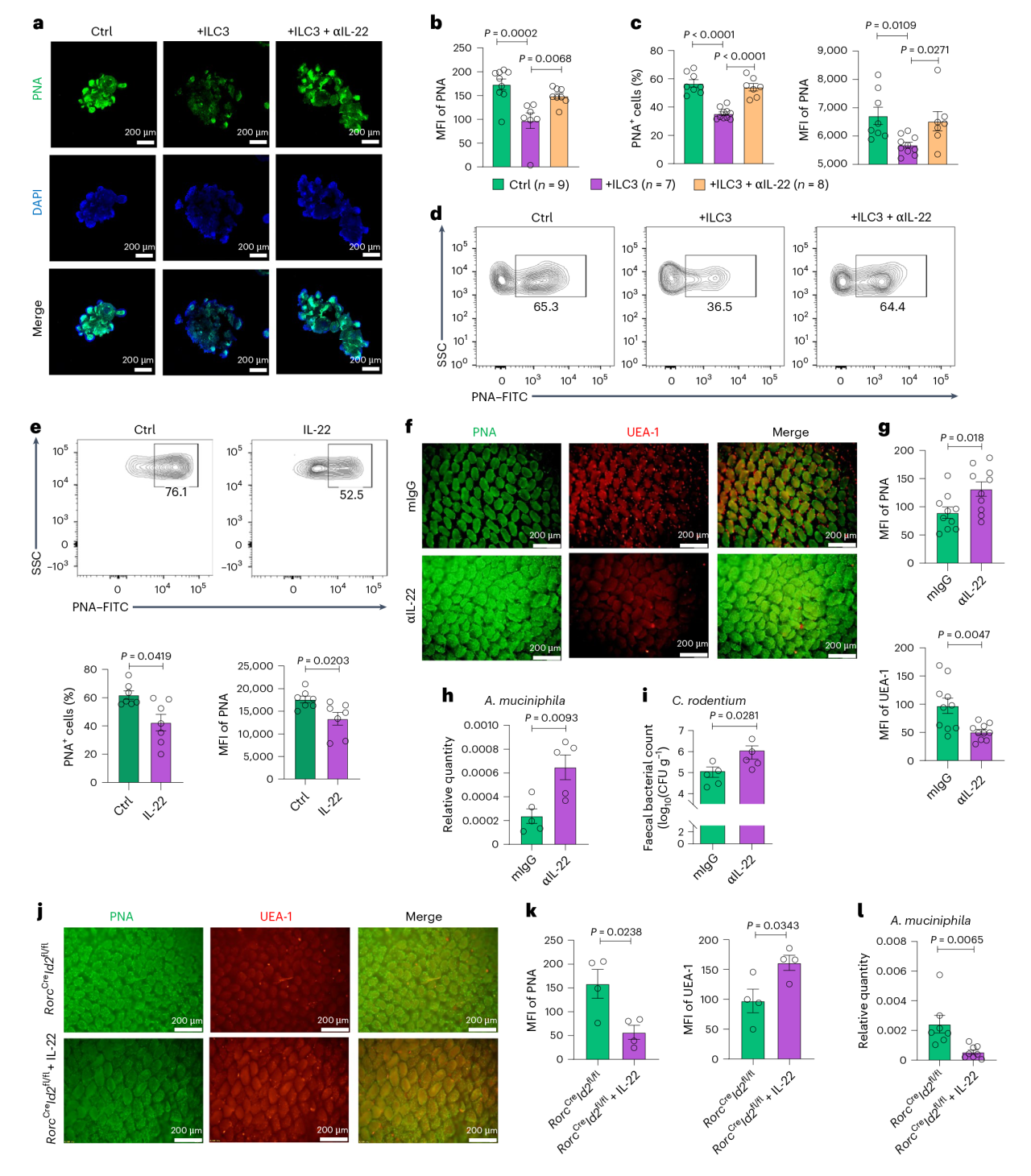 图6 ILC3s通过IL-22抑制肠道半乳糖基化
图6 ILC3s通过IL-22抑制肠道半乳糖基化
小结
该研究通过小鼠C.rodentium菌感染模型,发现ILC3s可以通过调节肠道微生物群来保护宿主免受感染。在机制上,ILC3s可以通过IL-22依赖性调节小鼠肠道半乳糖基化来控制肠道生态失调。ILC3缺乏导致肠道半乳糖基化增加,结肠粘液中共生A.muciniphila菌的扩增。A.muciniphila菌及其衍生代谢产物琥珀酸盐的增加进一步促进了病原菌毒力因子tir和ler的表达,导致对C.rodentium菌的易感性增加。
中科优品推荐 中科新生命不单有微生物组学技术,还就多组学联合应用推出多方向专业领域解决方案,为高分文章奠定扎实基础。