上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Cell Research | 躺着减肥不是梦?中南大学湘雅医院团队发现全新激素Raptin:睡眠诱导的天然食欲抑制剂
112 人阅读发布时间:2025-05-21 14:08
 睡眠不足是代谢性疾病的主要成因之一,最近临床研究显示,睡眠不足会增加能量摄入,但能量消耗没有差异,因此,睡眠不足导致肥胖的机制值得进一步研究。睡眠不足引起的昼夜节律紊乱可以扰乱食欲激素的水平,而下丘脑作为激素分泌的关键大脑区域,是否也受昼夜节律调控产生新激素抑制肥胖,仍待探讨。
2025 年 1 月,中南大学湘雅医院罗湘杭、彭慧团队在Cell Research(IF28.1)上发表题为“Raptin, a sleep-induced hypothalamic hormone, suppresses appetite and obesity”的文章,该研究通过蛋白质组学、互作蛋白鉴定、磷酸化蛋白质组学在人和小鼠中找到一种抑制肥胖的睡眠诱导下丘脑蛋白激素-Raptin,并解析了其在调节食欲和预防肥胖中关键机制,为治疗肥胖提供了潜在新靶点。
睡眠不足是代谢性疾病的主要成因之一,最近临床研究显示,睡眠不足会增加能量摄入,但能量消耗没有差异,因此,睡眠不足导致肥胖的机制值得进一步研究。睡眠不足引起的昼夜节律紊乱可以扰乱食欲激素的水平,而下丘脑作为激素分泌的关键大脑区域,是否也受昼夜节律调控产生新激素抑制肥胖,仍待探讨。
2025 年 1 月,中南大学湘雅医院罗湘杭、彭慧团队在Cell Research(IF28.1)上发表题为“Raptin, a sleep-induced hypothalamic hormone, suppresses appetite and obesity”的文章,该研究通过蛋白质组学、互作蛋白鉴定、磷酸化蛋白质组学在人和小鼠中找到一种抑制肥胖的睡眠诱导下丘脑蛋白激素-Raptin,并解析了其在调节食欲和预防肥胖中关键机制,为治疗肥胖提供了潜在新靶点。

研究设计
睡眠碎片化小鼠模型(SF)下丘脑、Raptin或PBS处理的小鼠下丘脑神经元、小鼠下丘脑GT1-7神经元与共His-Raptin孵育的细胞裂解液、肥胖患者和睡眠不足患者的血浆
技术方法
蛋白质组学、磷酸化蛋白质组学和蛋白鉴定
技术路线
步骤1:发现睡眠相关的下丘脑激素,并命名为Raptin
步骤2:探究Raptin的分泌机制
步骤3:研究Raptin调控肥胖的作用机制
步骤4:研究Raptin与临床相关性
研究结果
1.睡眠相关的下丘脑激素Raptin的首次发现
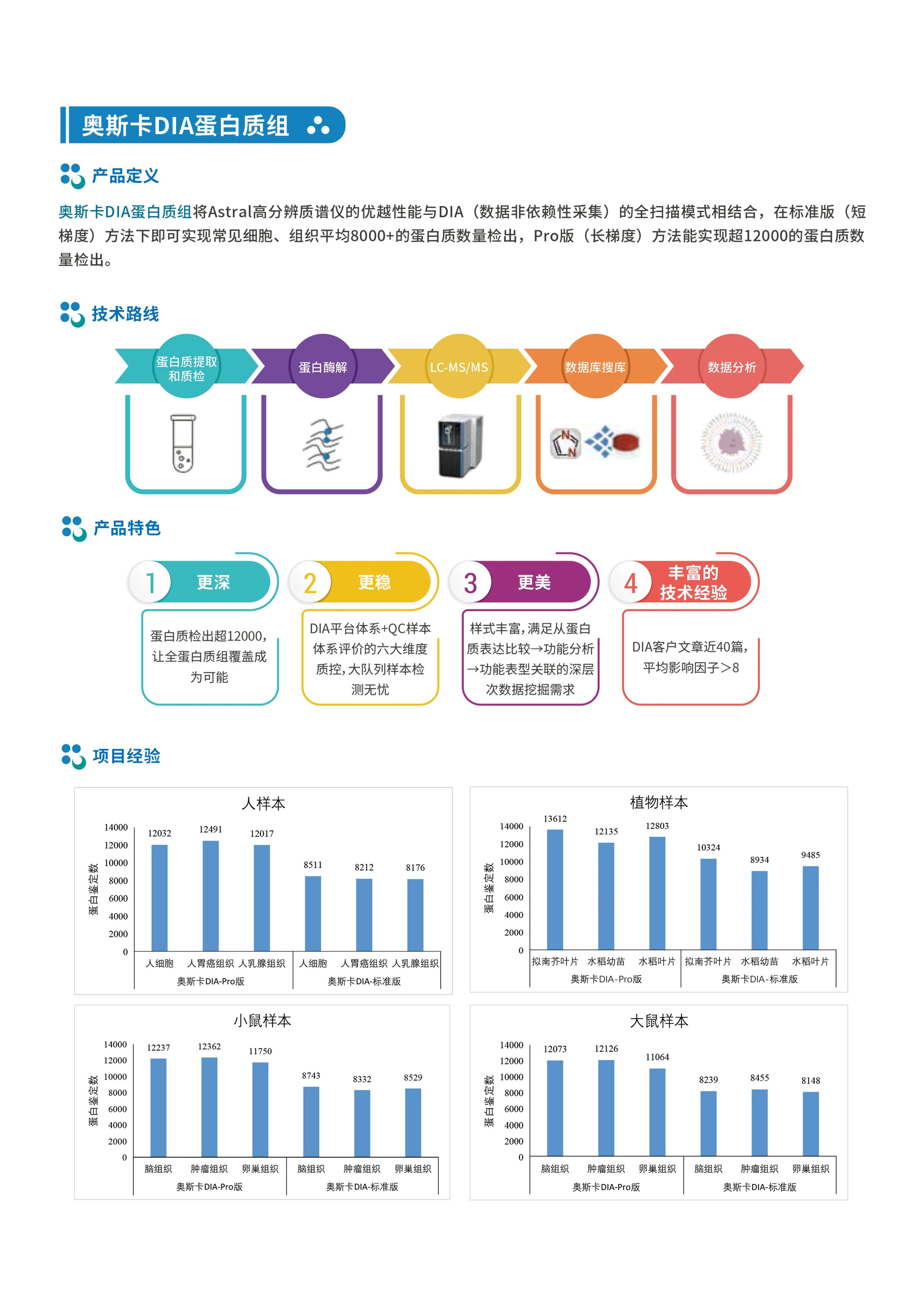
为了探究长期睡眠障碍如何导致肥胖,构建了睡眠碎片化(SF)小鼠模型,对SF小鼠和对照组的下丘脑进行蛋白质组分析,发现RCN2在SF组中显著下调(图1a)。
基于下丘脑scRNA-seq公共数据集以及免疫荧光实验,发现Rcn2主要在小鼠的下丘脑室旁核(PVN)神经元中表达(图1b-d),且在睡眠期间表达高于活跃期(图1e,f)。由于PVN是释放下丘脑激素的关键区域,推测RCN2可能是一种新的下丘脑激素。将融合Flag的全长Rcn2质粒转染下丘脑GT1-7神经元,鉴定关键分泌蛋白,并通过质谱序列鉴定,表明RCN2可以被切割成一个较短的片段,作者将其命名为Raptin(图1g)。并基于小鼠和人的血浆样本证实Raptin 在睡眠期间达到峰值(图1i,j)。
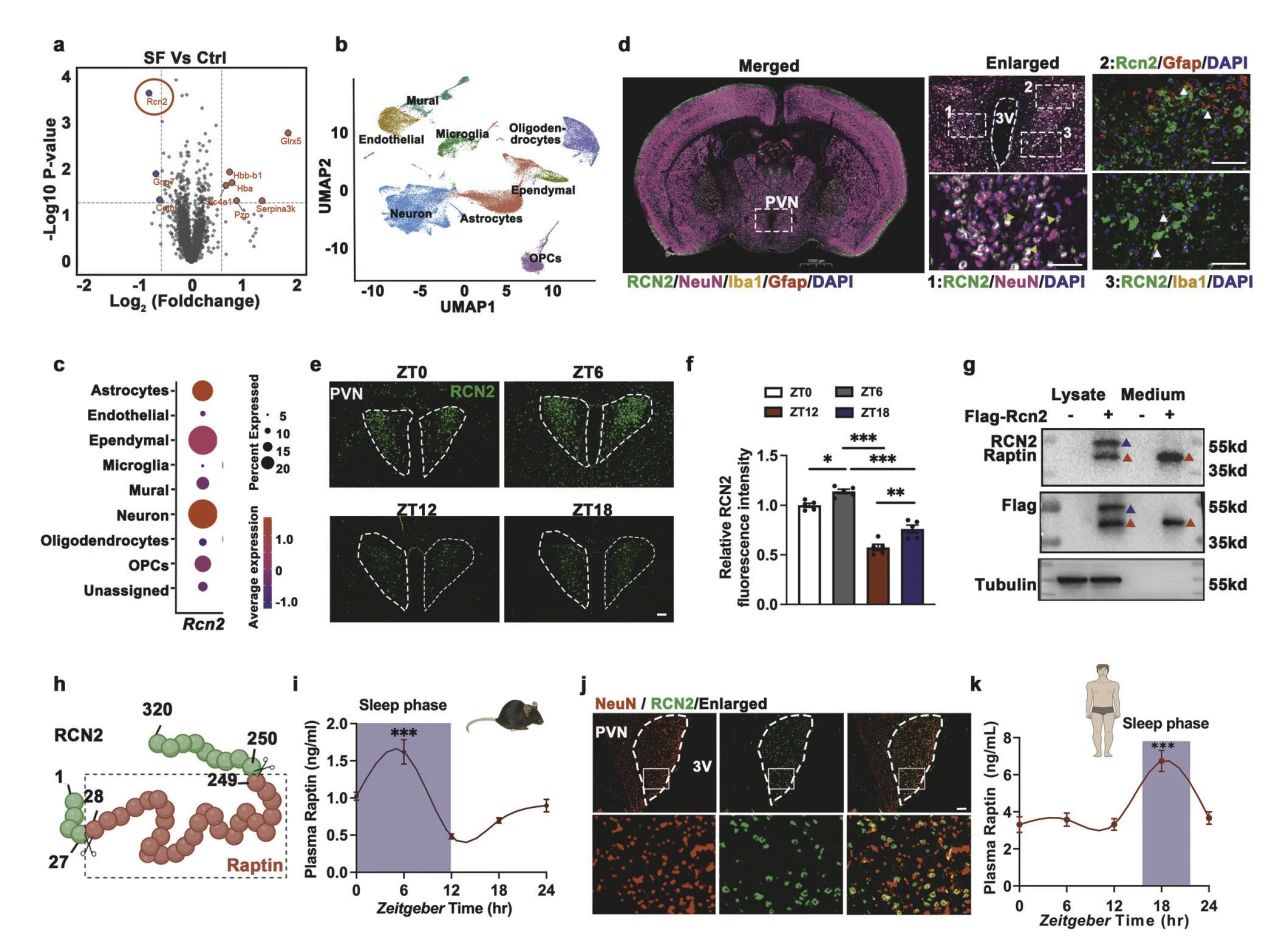 图1 Raptin是小鼠和人类睡眠诱导的下丘脑激素
2. Raptin的分泌机制
接下来作者探讨Raptin分泌的上游调控机制。视交叉上核(SCN)是中枢昼夜节律起搏器对PVN有强大的神经支配作用,协调PVN激素分泌的昼夜节律。研究表明SCN是通过血管加压素(AVP)神经元亚型控制PVNRCN2神经元活性(图2a-f)。并且,SCNAVP神经元抑制导致PVNRCN2神经元受到抑制减少Raptin释放,食物摄入增加(图2g-j)。以上表明Raptin的释放是由SCNAVP神经元到PVNRCN2神经元的神经回路控制。
图1 Raptin是小鼠和人类睡眠诱导的下丘脑激素
2. Raptin的分泌机制
接下来作者探讨Raptin分泌的上游调控机制。视交叉上核(SCN)是中枢昼夜节律起搏器对PVN有强大的神经支配作用,协调PVN激素分泌的昼夜节律。研究表明SCN是通过血管加压素(AVP)神经元亚型控制PVNRCN2神经元活性(图2a-f)。并且,SCNAVP神经元抑制导致PVNRCN2神经元受到抑制减少Raptin释放,食物摄入增加(图2g-j)。以上表明Raptin的释放是由SCNAVP神经元到PVNRCN2神经元的神经回路控制。
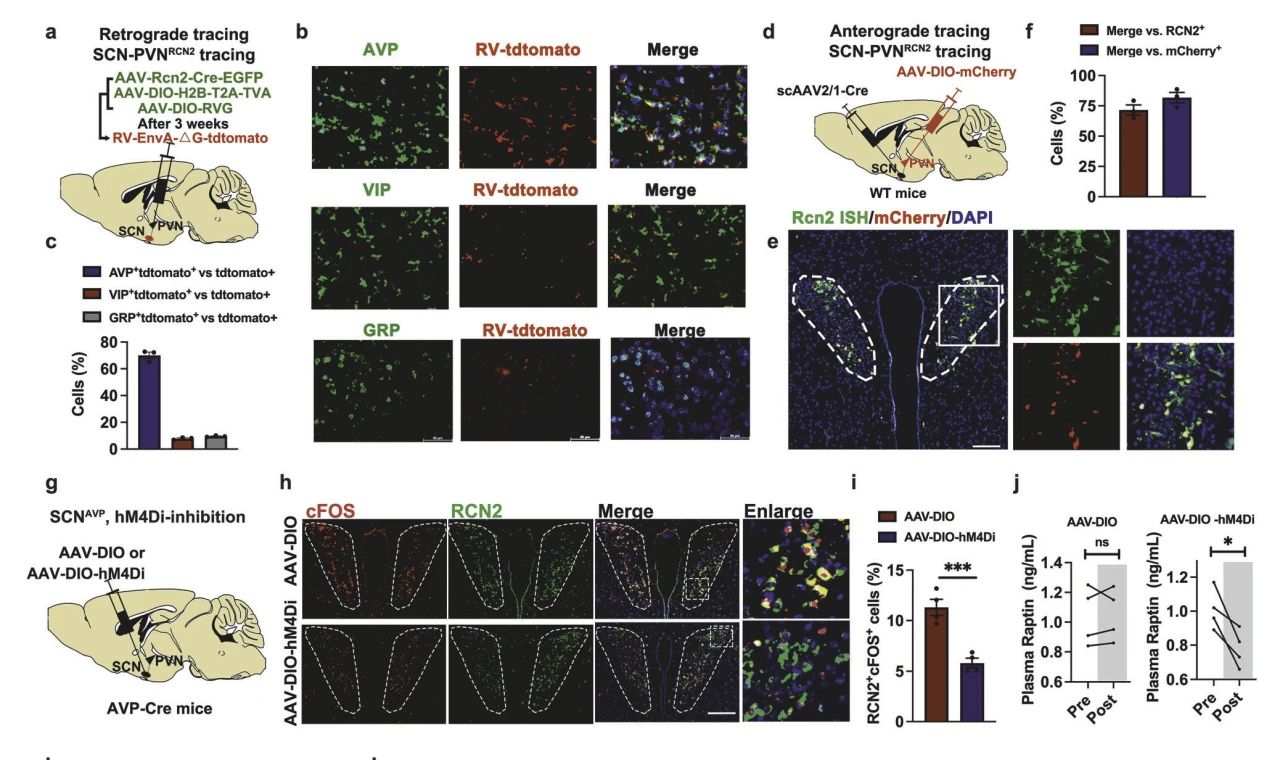 图2 Raptin释放的昼夜节律受SCNAVP神经元控制
3. Raptin 调控肥胖的作用机制
进一步建立Raptin与SF小鼠肥胖之间联系。发现,Raptin过表达减少过度体重增加,降低食物摄入量,挽救葡萄糖耐受性、胰岛素敏感性和脂肪积累的损害,而其敲除则会导致体重增加和能量消耗减少。以上表明Raptin可以抑制食物摄入并预防肥胖(图3)。
图2 Raptin释放的昼夜节律受SCNAVP神经元控制
3. Raptin 调控肥胖的作用机制
进一步建立Raptin与SF小鼠肥胖之间联系。发现,Raptin过表达减少过度体重增加,降低食物摄入量,挽救葡萄糖耐受性、胰岛素敏感性和脂肪积累的损害,而其敲除则会导致体重增加和能量消耗减少。以上表明Raptin可以抑制食物摄入并预防肥胖(图3)。
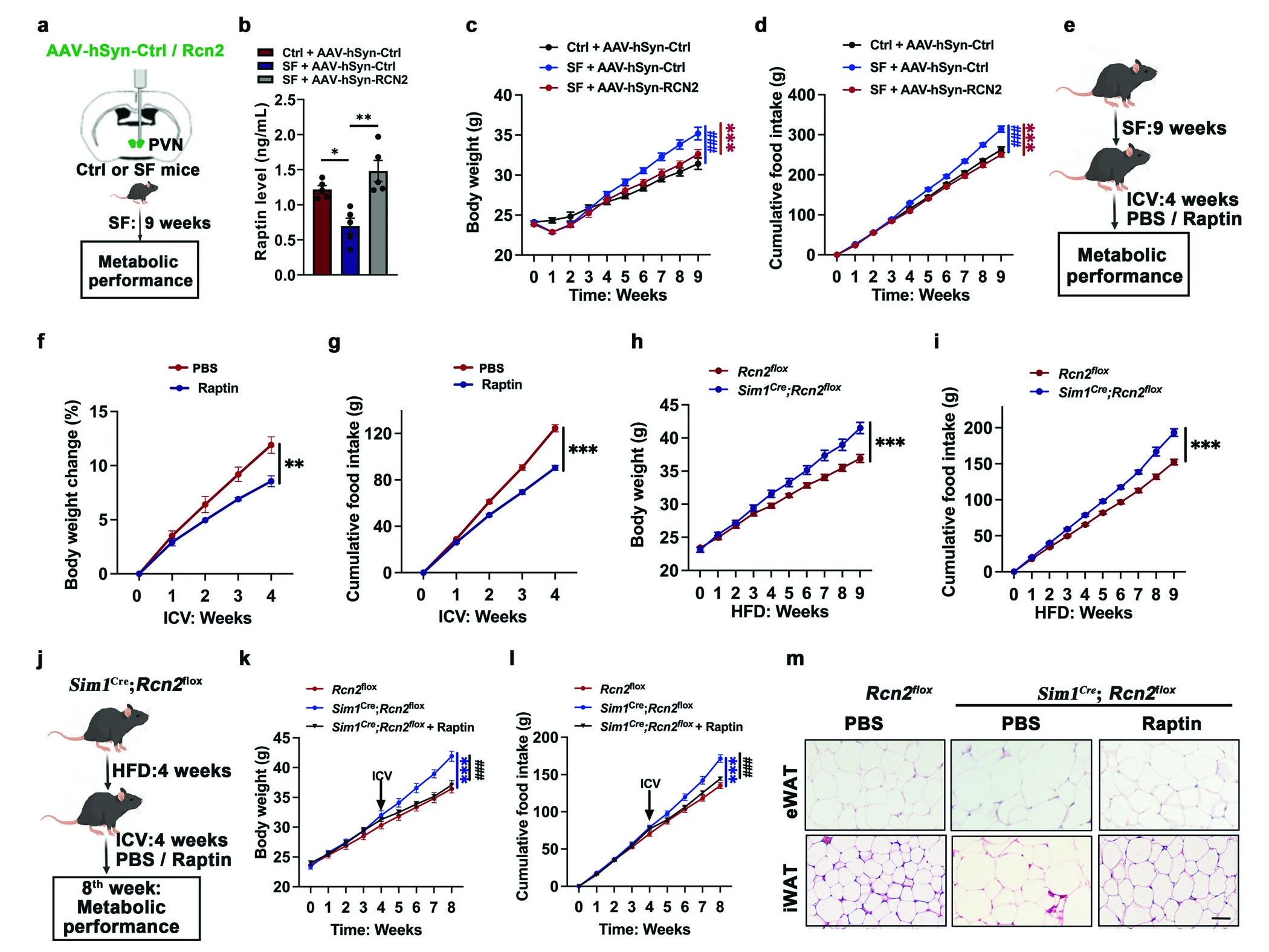 图3 下丘脑衍生的Raptin抑制食物摄入,防止肥胖
确认表型后,接下来进行机制探讨。为了确定Raptin的受体,从下丘脑GT1-7神经元中提取细胞裂解液,并用His-Raptin孵育,然后进行质谱鉴定,发现GRM3是Raptin新受体(图4a,b)。并通过饱和结合试验证实了Raptin和Grm3之间的结合(图4c)。
近一步发现GRM3在下丘脑和胃中高度表达,且GRM3在胃中与NOS1阳性的神经元共定位。而Raptin定位于下丘脑(PVN)和胃的肌层,因此通过构建PVN特异性Grm3敲除小鼠、胃NOS1阳性神经元特异性Grm3敲除小鼠,以及双组织特异性Grm3敲除小鼠,表明PVN来源的Raptin通过结合PVN和胃神经元中的Grm3来抑制食欲和胃排空,最终导致体重减轻(4D-N)。
图3 下丘脑衍生的Raptin抑制食物摄入,防止肥胖
确认表型后,接下来进行机制探讨。为了确定Raptin的受体,从下丘脑GT1-7神经元中提取细胞裂解液,并用His-Raptin孵育,然后进行质谱鉴定,发现GRM3是Raptin新受体(图4a,b)。并通过饱和结合试验证实了Raptin和Grm3之间的结合(图4c)。
近一步发现GRM3在下丘脑和胃中高度表达,且GRM3在胃中与NOS1阳性的神经元共定位。而Raptin定位于下丘脑(PVN)和胃的肌层,因此通过构建PVN特异性Grm3敲除小鼠、胃NOS1阳性神经元特异性Grm3敲除小鼠,以及双组织特异性Grm3敲除小鼠,表明PVN来源的Raptin通过结合PVN和胃神经元中的Grm3来抑制食欲和胃排空,最终导致体重减轻(4D-N)。
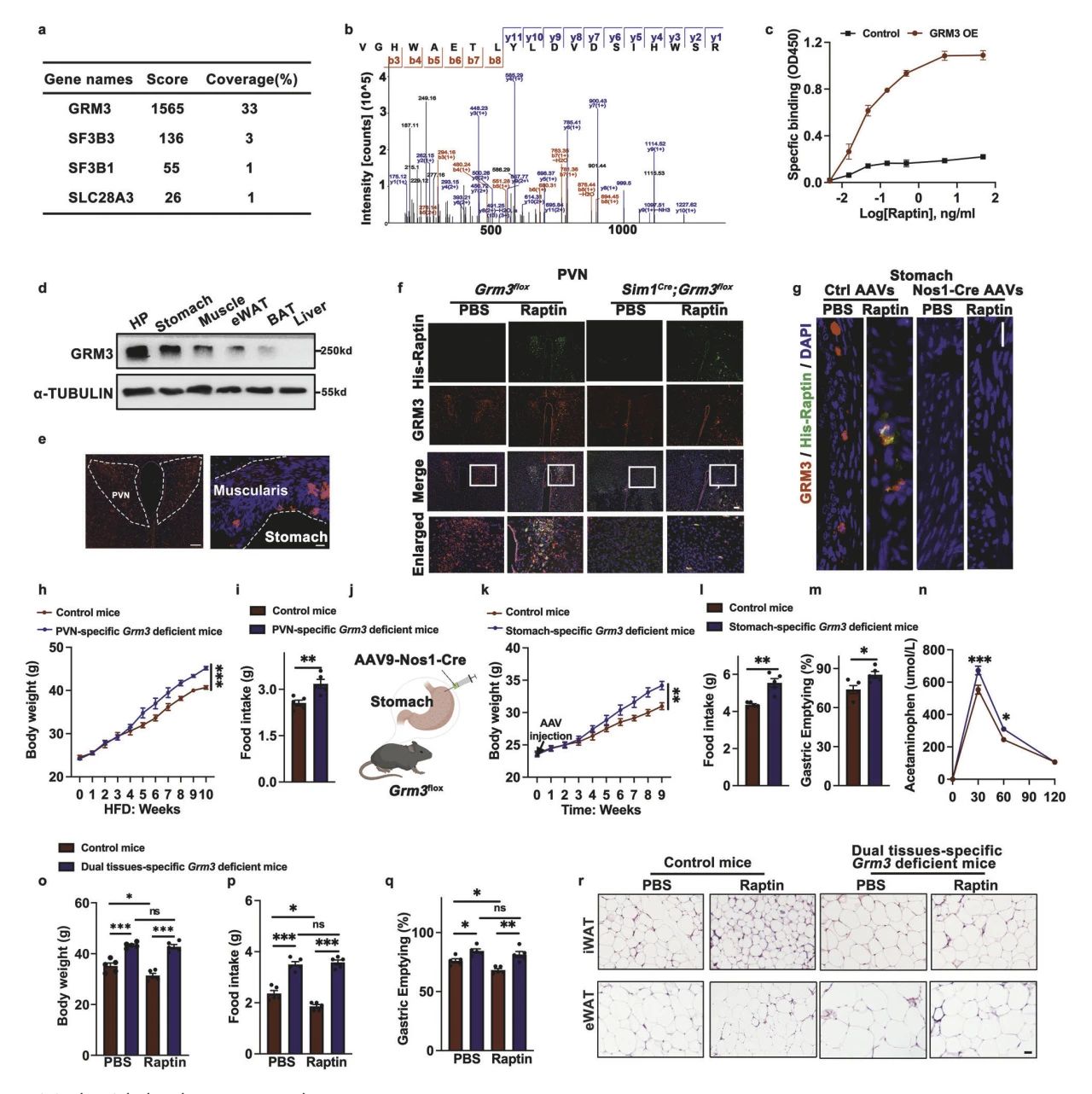 图4 Raptin与PVN和胃神经元中的GRM3结合,抑制食物摄入
由于Raptin是以Grm3依赖性方式激活PVNGRM3神经元和胃NOS1+神经元(图5a-d)。为阐明神经元激活的机制,研究者对Raptin或PBS处理的下丘脑神经元进行了磷酸化修饰组学分析,KEGG分析等结果表明Raptin结合GRM3后,激活PI3K-AKT途径,进而调控驱动蛋白重链(KHC)介导的线粒体运动,提高细胞内的ATP水平,为神经元的激活提供能量供应,从而抑制食欲和促进能量消耗(5e-n)。
图4 Raptin与PVN和胃神经元中的GRM3结合,抑制食物摄入
由于Raptin是以Grm3依赖性方式激活PVNGRM3神经元和胃NOS1+神经元(图5a-d)。为阐明神经元激活的机制,研究者对Raptin或PBS处理的下丘脑神经元进行了磷酸化修饰组学分析,KEGG分析等结果表明Raptin结合GRM3后,激活PI3K-AKT途径,进而调控驱动蛋白重链(KHC)介导的线粒体运动,提高细胞内的ATP水平,为神经元的激活提供能量供应,从而抑制食欲和促进能量消耗(5e-n)。
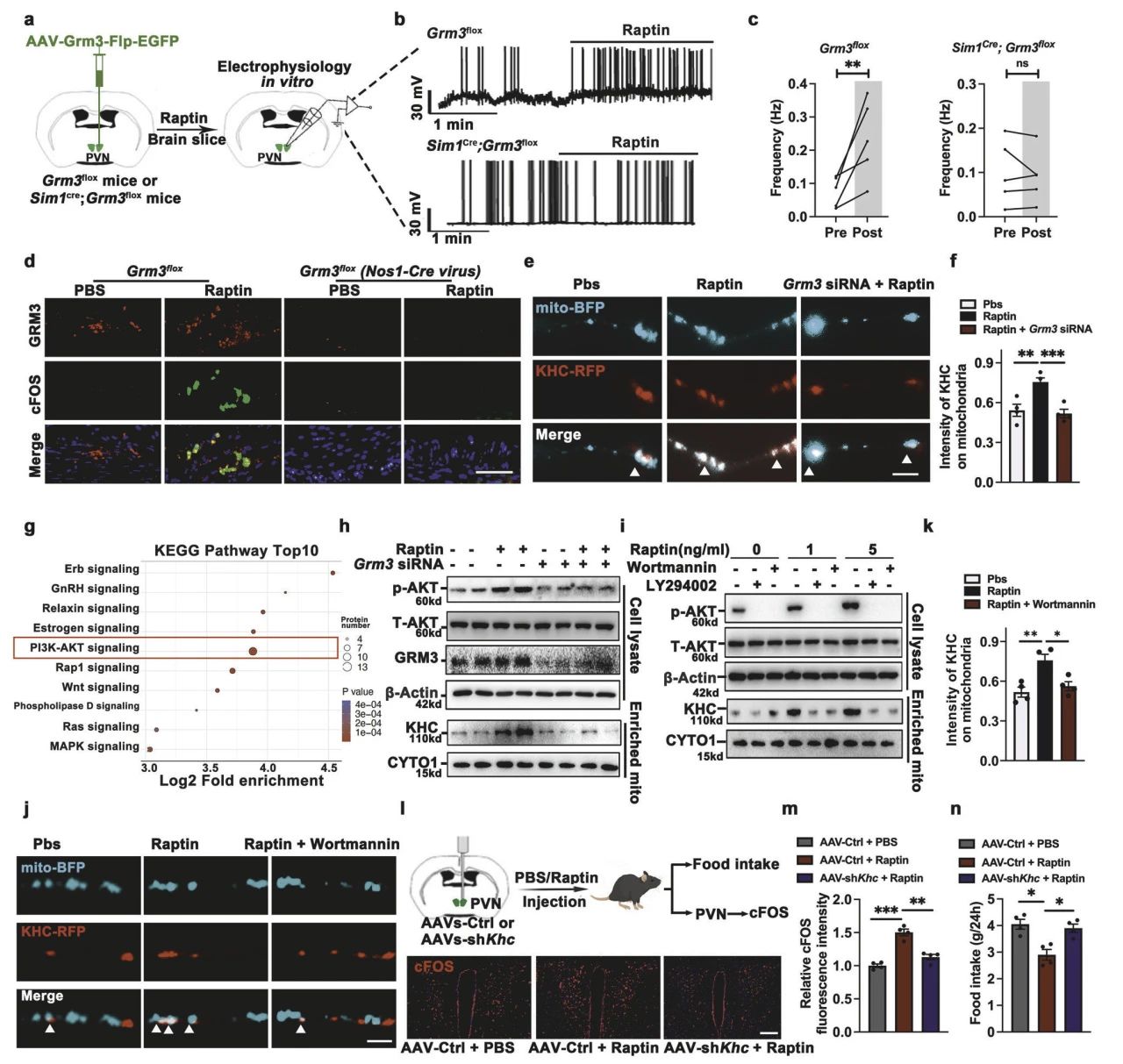 图5 Raptin-GRM3信号维持神经元激活和厌食作用的能量供应
4. 临床相关性
最后研究与临床的相关性,调查睡眠质量对人类肥胖的影响,基于262名参与者,探讨睡眠质量、Raptin释放和肥胖之间的相互作用。结果发现,肥胖人群的睡眠质量、血浆Raptin水平显著低于非肥胖人群、肥胖人群SE(睡眠效率)与BMI负相关,与Raptin水平正相关,BMI与Raptin水平呈明显的负相关,提示睡眠不足可能会破坏Raptin释放,尤其是在肥胖情况下(图6a-f)。
鉴于睡眠质量紊乱与肥胖发展之间存在既定的关联,作者探索肥胖和失眠患者睡眠质量的改善是否可以促进Raptin的释放并抑制食物摄入。招募男性肥胖和失眠患者,经过睡眠限制疗法(SRT)3个月,发现接受SRT治疗的患者在SE、体重和能量摄入以及血浆Raptin水平方面表现出显著改善。此外,Raptin水平的变化与SE改善呈正相关,与体重和能量摄入的减少呈负相关(图6g-n)。
图5 Raptin-GRM3信号维持神经元激活和厌食作用的能量供应
4. 临床相关性
最后研究与临床的相关性,调查睡眠质量对人类肥胖的影响,基于262名参与者,探讨睡眠质量、Raptin释放和肥胖之间的相互作用。结果发现,肥胖人群的睡眠质量、血浆Raptin水平显著低于非肥胖人群、肥胖人群SE(睡眠效率)与BMI负相关,与Raptin水平正相关,BMI与Raptin水平呈明显的负相关,提示睡眠不足可能会破坏Raptin释放,尤其是在肥胖情况下(图6a-f)。
鉴于睡眠质量紊乱与肥胖发展之间存在既定的关联,作者探索肥胖和失眠患者睡眠质量的改善是否可以促进Raptin的释放并抑制食物摄入。招募男性肥胖和失眠患者,经过睡眠限制疗法(SRT)3个月,发现接受SRT治疗的患者在SE、体重和能量摄入以及血浆Raptin水平方面表现出显著改善。此外,Raptin水平的变化与SE改善呈正相关,与体重和能量摄入的减少呈负相关(图6g-n)。
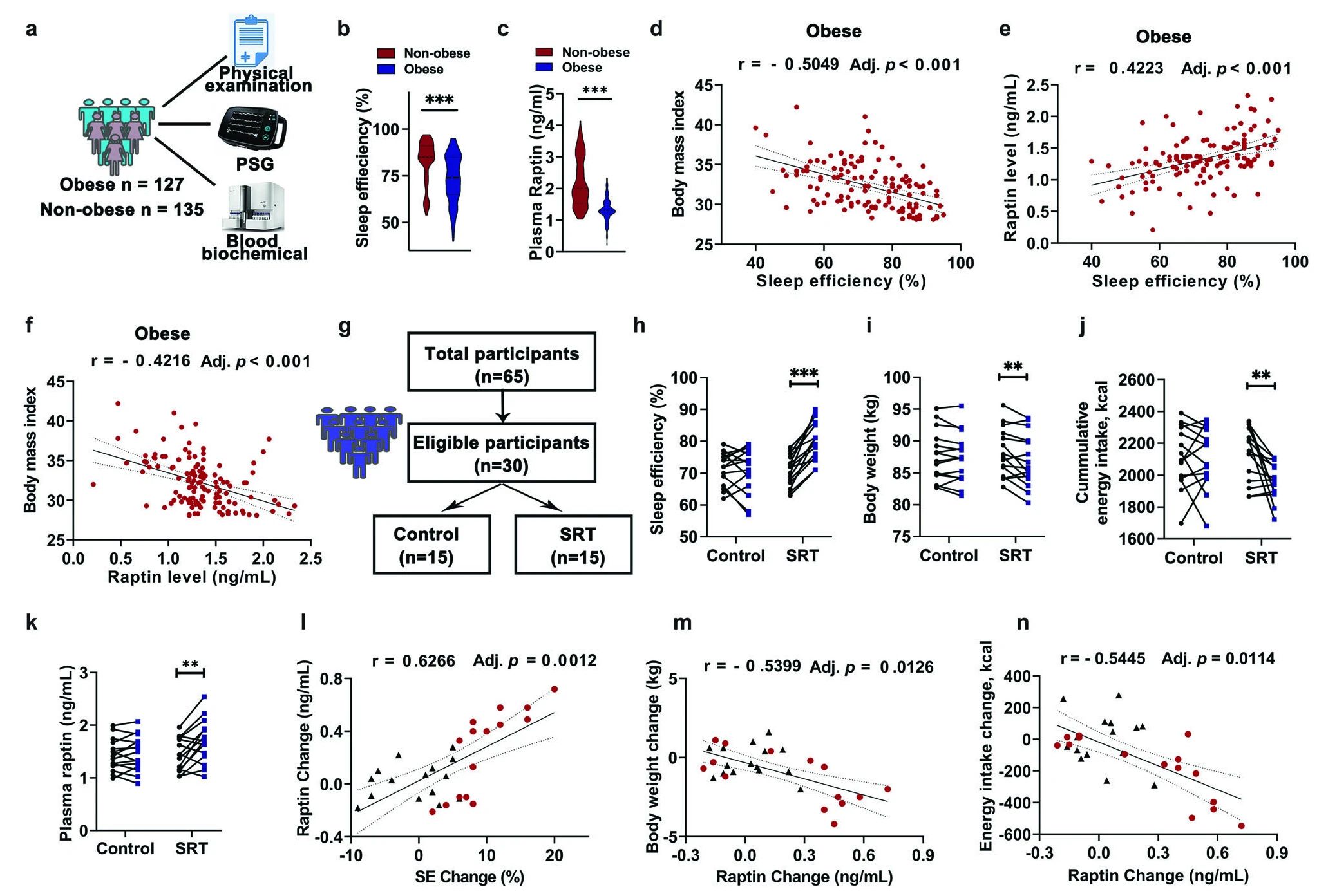 图6 Raptin参与了人类睡眠不足引起的肥胖
图6 Raptin参与了人类睡眠不足引起的肥胖
文章小结
该文基于蛋白质组学、互作蛋白鉴定和磷酸化蛋白质组学发现了在人类和小鼠中睡眠诱导的下丘脑激素Raptin可抑制肥胖,该激素在睡眠期间达到峰值,其释放由SCNAVP神经元到PVNRCN2阳性神经元的神经回路调控;通过与下丘脑和胃神经元中的GRM3结合,Raptin能抑制食欲和胃排空,并且Raptin-GRM3信号通过PI3K-AKT信号介导厌食效应。该文发现了睡眠状态缺陷、Raptin释放受损与睡眠不足患者肥胖之间的联系,为体重控制提供了新的见解。
中科优品推荐 【中科新生命】自2016年开始提供DIA定量蛋白质组学服务至今,已形成了从高通量检测到分析的完整技术平台,开发了特色激酶分析及与其他组学的联合分析方案,已助力客户发表了几十篇高分文章。DIA定量蛋白质组学的更高通量、更深覆盖、更高灵敏度及精确定量的显著优势已深入人心。