上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Mol Cancer|云平台助力上海市东方医院董春燕团队发现TNBC潜在治疗靶点ZNF526
50 人阅读发布时间:2025-12-18 10:03
 三阴性乳腺癌(TNBC)是一种侵袭性恶性肿瘤,治疗选择有限,预后差。ZNF526的单核苷酸多态性rs3810151(p.Val94Ala)已被确定为乳腺癌易感位点,但ZNF526在TNBC中的功能作用和机制基础尚不清楚。
2025年11月,同济大学附属东方医院董春燕团队在 Molecular Cancer(IF33.9)发表了题为”ZNF526 drives tumor growth by enhancing SHMT1-dependent serine metabolism and antioxidant capability in TNBC”的文章。文章揭示了ZNF526是通过SHMT1介导的代谢控制TNBC中氧化还原平衡的一种新的调节剂,将其定位为TNBC的潜在治疗靶点。中科新生命为该研究提供了云平台分析服务。
三阴性乳腺癌(TNBC)是一种侵袭性恶性肿瘤,治疗选择有限,预后差。ZNF526的单核苷酸多态性rs3810151(p.Val94Ala)已被确定为乳腺癌易感位点,但ZNF526在TNBC中的功能作用和机制基础尚不清楚。
2025年11月,同济大学附属东方医院董春燕团队在 Molecular Cancer(IF33.9)发表了题为”ZNF526 drives tumor growth by enhancing SHMT1-dependent serine metabolism and antioxidant capability in TNBC”的文章。文章揭示了ZNF526是通过SHMT1介导的代谢控制TNBC中氧化还原平衡的一种新的调节剂,将其定位为TNBC的潜在治疗靶点。中科新生命为该研究提供了云平台分析服务。

研究材料 人乳腺癌组织样本、乳腺癌细胞、小鼠血清、肿瘤组织
技术方法 转录组测序、非靶代谢组、ELISA、免疫组化、Chip-seq、DCFH-DA荧光检测、WB、RT-qPCR、ChIP-qPCR等;
研究步骤 步骤1:通过TCGA数据分析ZNF526转录水平,预测患者总生存期,免疫组化检测蛋白水平; 步骤2:通过构建敲除和过表达细胞,观测细胞生长,以及通过流式细胞术分析细胞周期分布; 步骤3:代谢组学检测,确定显著富集SGOC相关代谢途径以及关键代谢物情况; 步骤4:DCFH-DA荧光法检测敲除或过表达细胞ROS水平; 步骤5:RNA测序发现关键通路关键酶,RT-qPCR和WB验证,荧光素酶检测启动子驱动的荧光素酶活性,Chip-seq验证SHMT1启动子区域富集情况; 步骤6:敲除或抑制znf526过表达细胞中的SHMT1,检测代谢物、ROS水平; 步骤7:建立小鼠异种移植模型,观测肿瘤生长、代谢物检测、免疫组化、SHMT1表达检测、ROS水平检测。
研究结果 1. ZNF526在TNBC肿瘤组织中高表达,与预后呈负相关 通过TCGA数据库评估ZNF526 mRNA在乳腺癌亚型中的表达显示,ZNF526在肿瘤组织中的表达明显高于正常组织,且TNBC在所有亚型中ZNF526表达水平最高。另外,免疫组化分析显示,与正常对照(n = 35)相比,TNBC(n = 120)和非TNBC(n = 80)组织中ZNF526蛋白水平均显著升高,TNBC在所有组中表达水平最高。最后分析TCGA数据集,发现高表达的ZNF526预测TNBC患者较差的总生存期。相比之下,ZNF526在其他亚型中要么显示边缘阳性关联(luminal),要么没有预后价值(her2阳性)。
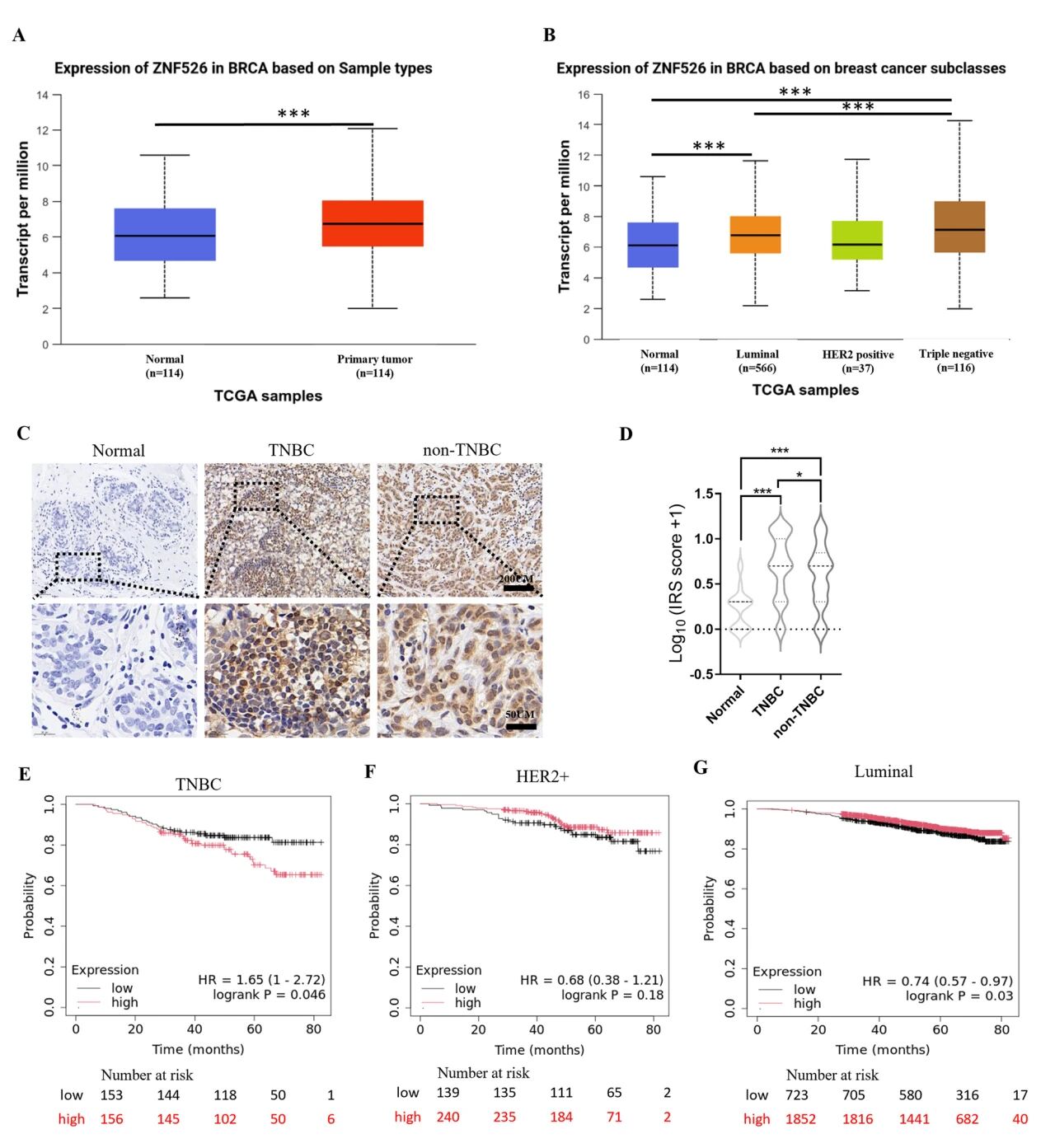 图1 ZNF526在TNBC肿瘤组织中高表达,与预后呈负相关
2. ZNF526促进TNBC中癌细胞生长
在MDA-MB-231、MDA-MB-468、BT-20和HCC1806中产生了稳定的过表达ZNF526的细胞系。体外细胞生长实验表明,ZNF526过表达显著促进细胞生长,突变体ZNF526 (Val94Ala)在过表达时比野生型ZNF526表现出更强的促生长作用。构建shZNF526或ZNF526-KO稳定细胞系,shZNF526或ZNF526-KO显著抑制细胞生长。利用流式细胞术分析了细胞周期分布,ZNF526敲低诱导细胞系明显的G1期阻滞,相反,ZNF526在细胞中过表达降低了G1期比例,同时增加了S期比例。WB分析显示,ZNF526敲除下调了CCND1表达,抑制了Rb蛋白的磷酸化,同时上调了p21。而ZNF526过表达升高CCND1和phospho-Rb的水平,并降低p21的表达。
图1 ZNF526在TNBC肿瘤组织中高表达,与预后呈负相关
2. ZNF526促进TNBC中癌细胞生长
在MDA-MB-231、MDA-MB-468、BT-20和HCC1806中产生了稳定的过表达ZNF526的细胞系。体外细胞生长实验表明,ZNF526过表达显著促进细胞生长,突变体ZNF526 (Val94Ala)在过表达时比野生型ZNF526表现出更强的促生长作用。构建shZNF526或ZNF526-KO稳定细胞系,shZNF526或ZNF526-KO显著抑制细胞生长。利用流式细胞术分析了细胞周期分布,ZNF526敲低诱导细胞系明显的G1期阻滞,相反,ZNF526在细胞中过表达降低了G1期比例,同时增加了S期比例。WB分析显示,ZNF526敲除下调了CCND1表达,抑制了Rb蛋白的磷酸化,同时上调了p21。而ZNF526过表达升高CCND1和phospho-Rb的水平,并降低p21的表达。
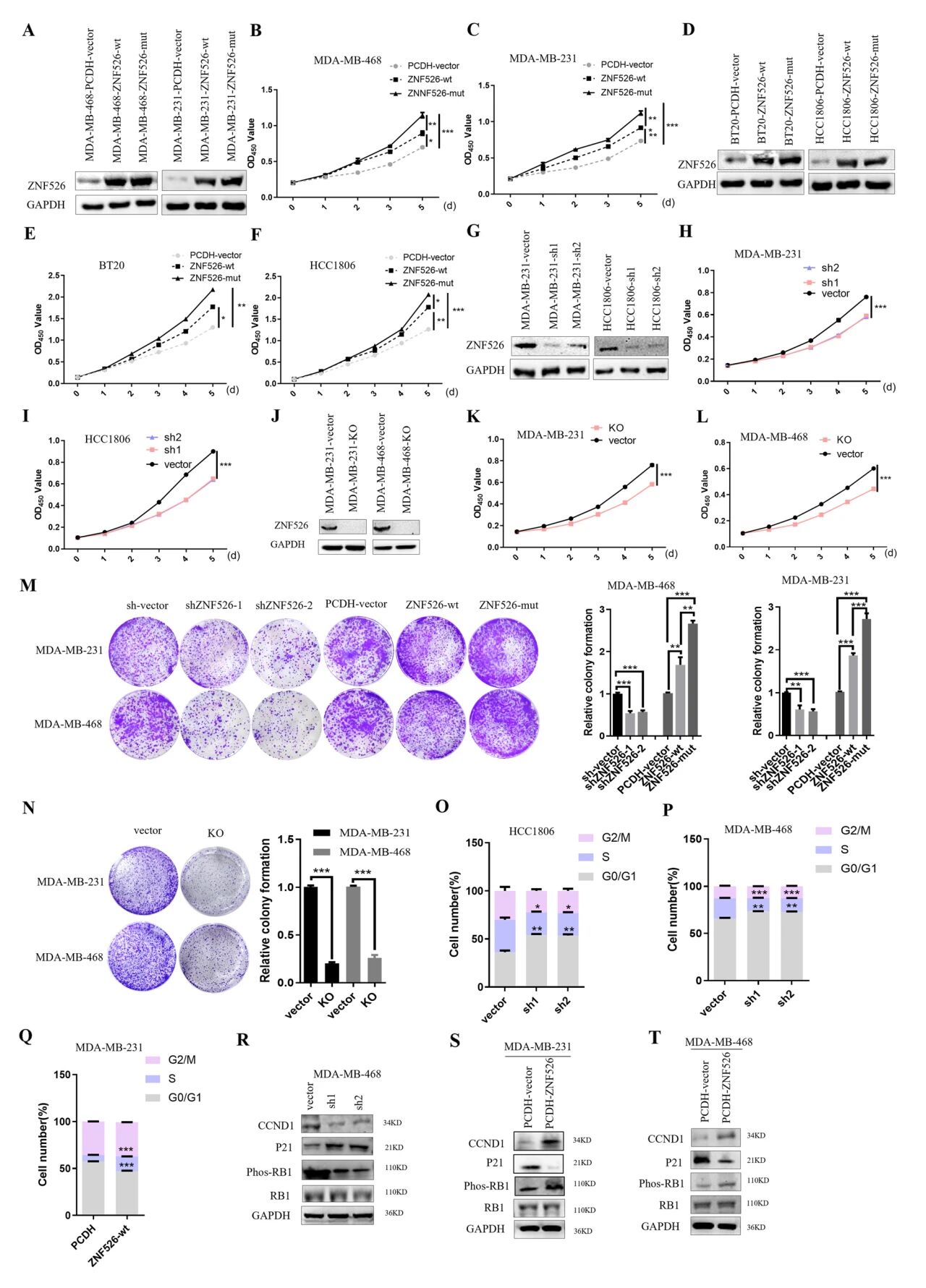 图2 ZNF526促进TNBC中癌细胞生长
3. ZNF526调节SGOC代谢和细胞GSH水平
对ZNF526过表达后细胞进行了非靶向代谢组学分析,MSEA显示,SGOC相关代谢途径显著富集,包括甘氨酸-丝氨酸-苏氨酸代谢、半胱氨酸和蛋氨酸代谢,以及叶酸介导的单碳池,靶向代谢组学证实,SGOC通路的关键代谢物如GSH、SAM、5-甲基thf在ZNF526过表达时显著上调。测试SGOC主要分支的代谢物:嘌呤和嘧啶(核苷),SAM和GSH发现SAM和核苷都不能恢复ZNF526敲低引起的生长损失,补充谷胱甘肽可显著减轻shznf526诱导的细胞生长缺陷。进一步测量ZNF526敲除或过表达后细胞中GSH和GSSG的水平。结果表明,ZNF526基因敲除显著降低GSH/GSSG比值、GSH水平和总谷胱甘肽含量。相反,ZNF526过表达显著增加了这些参数,在突变体ZNF526- v94a过表达细胞中观察到的增加更为显著。
图2 ZNF526促进TNBC中癌细胞生长
3. ZNF526调节SGOC代谢和细胞GSH水平
对ZNF526过表达后细胞进行了非靶向代谢组学分析,MSEA显示,SGOC相关代谢途径显著富集,包括甘氨酸-丝氨酸-苏氨酸代谢、半胱氨酸和蛋氨酸代谢,以及叶酸介导的单碳池,靶向代谢组学证实,SGOC通路的关键代谢物如GSH、SAM、5-甲基thf在ZNF526过表达时显著上调。测试SGOC主要分支的代谢物:嘌呤和嘧啶(核苷),SAM和GSH发现SAM和核苷都不能恢复ZNF526敲低引起的生长损失,补充谷胱甘肽可显著减轻shznf526诱导的细胞生长缺陷。进一步测量ZNF526敲除或过表达后细胞中GSH和GSSG的水平。结果表明,ZNF526基因敲除显著降低GSH/GSSG比值、GSH水平和总谷胱甘肽含量。相反,ZNF526过表达显著增加了这些参数,在突变体ZNF526- v94a过表达细胞中观察到的增加更为显著。
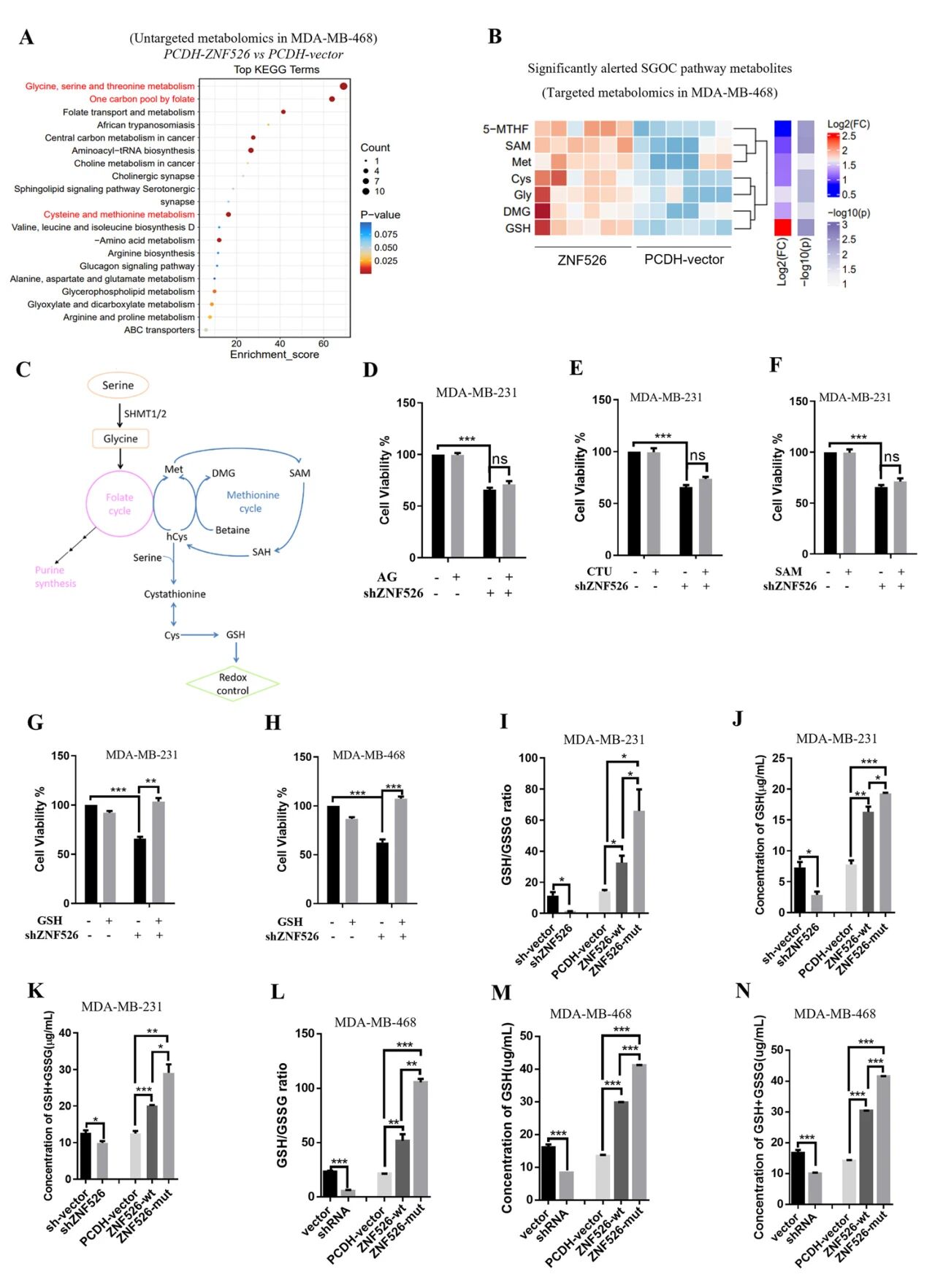 图3 ZNF526调节SGOC代谢和细胞GSH水平
4. ZNF526增强细胞抗氧化能力
测量ZNF526敲除或过表达后的细胞ROS水平发现ZNF526敲除显著提高细胞内ROS水平。相反,ZNF526过表达有效地减弱了ROS的积累,表达突变体ZNF526- v94a的细胞表现出更明显的ROS水平降低。进一步检测NAC发现NAC处理可有效降低ZNF526敲低诱导的ROS积累,并显著恢复细胞生长,以及H2O2处理显著抑制细胞活力,ZNF526过表达显著减弱了H2O2诱导的细胞活力丧失。
图3 ZNF526调节SGOC代谢和细胞GSH水平
4. ZNF526增强细胞抗氧化能力
测量ZNF526敲除或过表达后的细胞ROS水平发现ZNF526敲除显著提高细胞内ROS水平。相反,ZNF526过表达有效地减弱了ROS的积累,表达突变体ZNF526- v94a的细胞表现出更明显的ROS水平降低。进一步检测NAC发现NAC处理可有效降低ZNF526敲低诱导的ROS积累,并显著恢复细胞生长,以及H2O2处理显著抑制细胞活力,ZNF526过表达显著减弱了H2O2诱导的细胞活力丧失。
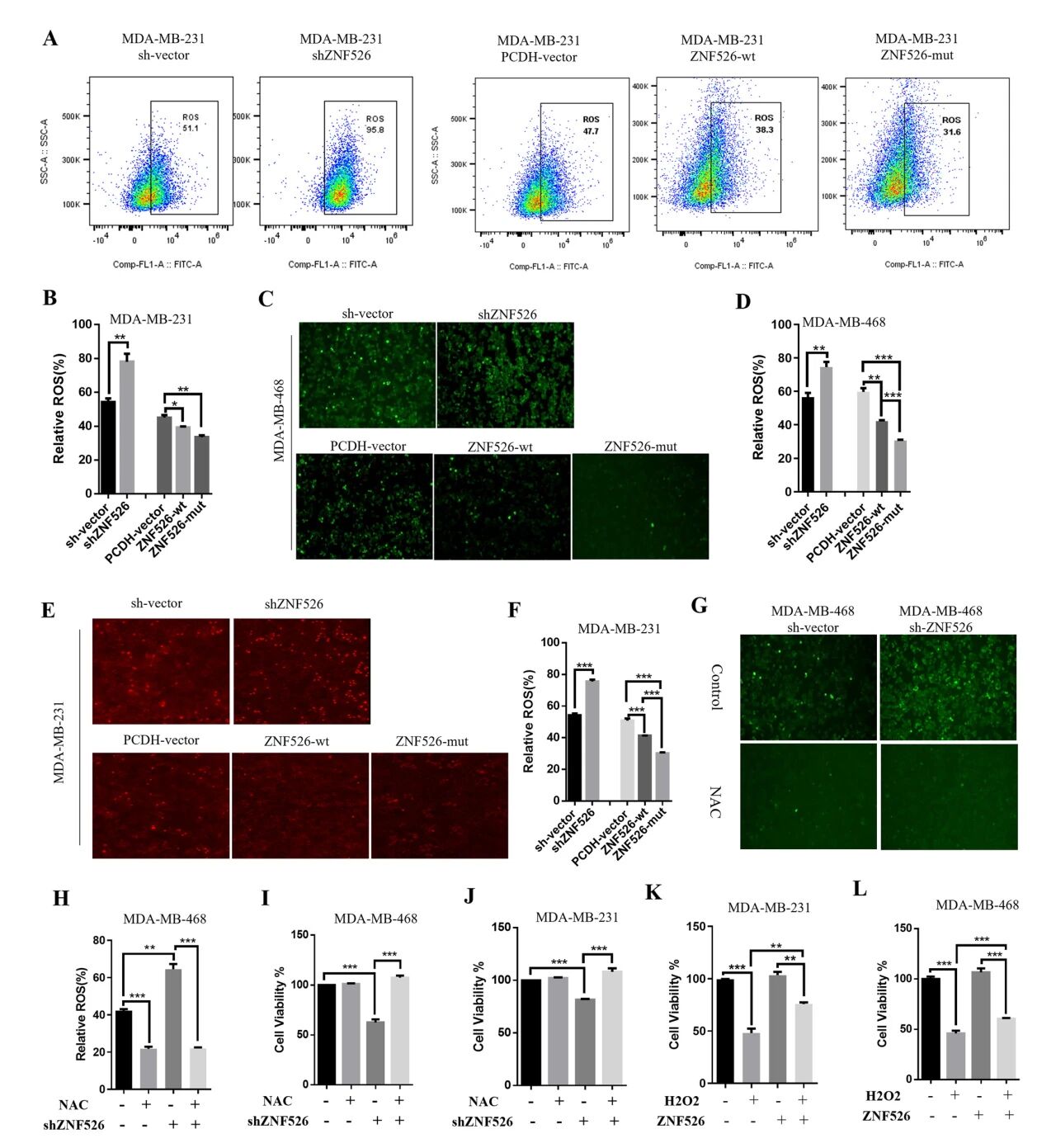 图4 ZNF526增强细胞抗氧化能力
5. ZNF526通过转录上调SHMT1的表达
RNA测序显示,ZNF526过表达显著上调了SGOC通路中的关键代谢酶SHMT1,RT-qPCR分析证实,ZNF526过表达显著上调SHMT1表达,而ZNF526敲低则大幅下调SHMT1表达。与野生型ZNF526过表达细胞相比,过表达突变体ZNF526- v94a的细胞表现出更明显的SHMT1 mRNA诱导。WB分析进一步在蛋白水平上得到验证。在HEK293T细胞中使用一系列由SHMT1启动子片段驱动的荧光素酶报告质粒进行了荧光素酶报告基因检测。结果表明,ZNF526显著增强了SHMT1启动子驱动的荧光素酶活性。缺失定位分析表明,ZNF526的潜在结合位点位于SHMT1转录起始位点(TSS)下游500 bp的区域内。利用JASPAR在线数据库进行进一步预测,确定了SHMT1启动子区域内两个串联排列的潜在znf526结合位点(指定位点1和位点2)。进一步设计荧光素酶报告基因结构,其中包含野生型SHMT1启动子、每个znf526结合位点(mut1或mut2)的单个突变或双突变(mut1 + 2)。报告者实验显示,两个结合位点的单个突变显著减弱了znf526依赖性荧光素酶的激活,而两个位点的联合突变完全消除了这种诱导。Chip-seq检测表明与对照IgG相比,ZNF526在SHMT1启动子区域显著富集。荧光素酶报告基因检测显示,与野生型ZNF526相比,突变体ZNF526- V94A诱导的信号传导明显更高,同样,ChIP-qPCR分析显示突变体ZNF526与SHMT1启动子区域的结合亲和力更强。分析了TCGA数据,观察到ZNF526和SHMT1 mRNA水平之间存在显著的正相关。此外,在TNBC患者中,SHMT1的高表达与较差的总生存率显著相关。
图4 ZNF526增强细胞抗氧化能力
5. ZNF526通过转录上调SHMT1的表达
RNA测序显示,ZNF526过表达显著上调了SGOC通路中的关键代谢酶SHMT1,RT-qPCR分析证实,ZNF526过表达显著上调SHMT1表达,而ZNF526敲低则大幅下调SHMT1表达。与野生型ZNF526过表达细胞相比,过表达突变体ZNF526- v94a的细胞表现出更明显的SHMT1 mRNA诱导。WB分析进一步在蛋白水平上得到验证。在HEK293T细胞中使用一系列由SHMT1启动子片段驱动的荧光素酶报告质粒进行了荧光素酶报告基因检测。结果表明,ZNF526显著增强了SHMT1启动子驱动的荧光素酶活性。缺失定位分析表明,ZNF526的潜在结合位点位于SHMT1转录起始位点(TSS)下游500 bp的区域内。利用JASPAR在线数据库进行进一步预测,确定了SHMT1启动子区域内两个串联排列的潜在znf526结合位点(指定位点1和位点2)。进一步设计荧光素酶报告基因结构,其中包含野生型SHMT1启动子、每个znf526结合位点(mut1或mut2)的单个突变或双突变(mut1 + 2)。报告者实验显示,两个结合位点的单个突变显著减弱了znf526依赖性荧光素酶的激活,而两个位点的联合突变完全消除了这种诱导。Chip-seq检测表明与对照IgG相比,ZNF526在SHMT1启动子区域显著富集。荧光素酶报告基因检测显示,与野生型ZNF526相比,突变体ZNF526- V94A诱导的信号传导明显更高,同样,ChIP-qPCR分析显示突变体ZNF526与SHMT1启动子区域的结合亲和力更强。分析了TCGA数据,观察到ZNF526和SHMT1 mRNA水平之间存在显著的正相关。此外,在TNBC患者中,SHMT1的高表达与较差的总生存率显著相关。
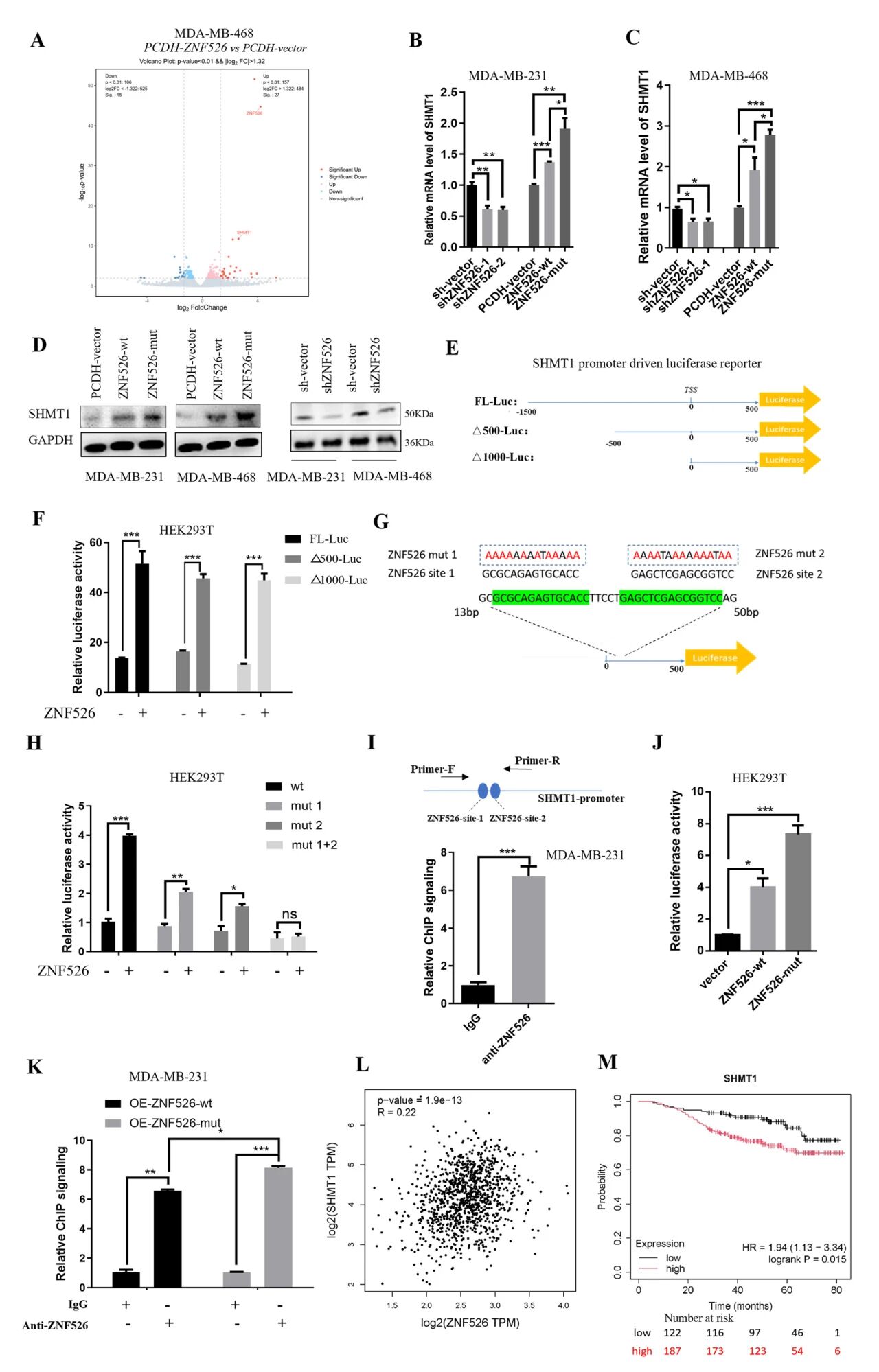 图5 ZNF526通过转录上调SHMT1的表达
6. SHMT1介导ZNF526的抗氧化和促生长作用
抑制过表达znf526的TNBC细胞中的SHMT1发现shmt1敲低显著减弱znf526诱导的谷胱甘肽升高,显著降低MDA-MB-231和MDA-MB-468细胞中GSH/GSSG比值,SHMT1敲低明显减弱znf526介导的ROS抑制,提高MDA-MB-231和MDA-MB-468细胞内ROS水平。ROS检测实验显示,SHIN1抑制SHMT1会损害ZNF526抑制MDA-MB-468细胞中ROS水平的能力。
图5 ZNF526通过转录上调SHMT1的表达
6. SHMT1介导ZNF526的抗氧化和促生长作用
抑制过表达znf526的TNBC细胞中的SHMT1发现shmt1敲低显著减弱znf526诱导的谷胱甘肽升高,显著降低MDA-MB-231和MDA-MB-468细胞中GSH/GSSG比值,SHMT1敲低明显减弱znf526介导的ROS抑制,提高MDA-MB-231和MDA-MB-468细胞内ROS水平。ROS检测实验显示,SHIN1抑制SHMT1会损害ZNF526抑制MDA-MB-468细胞中ROS水平的能力。
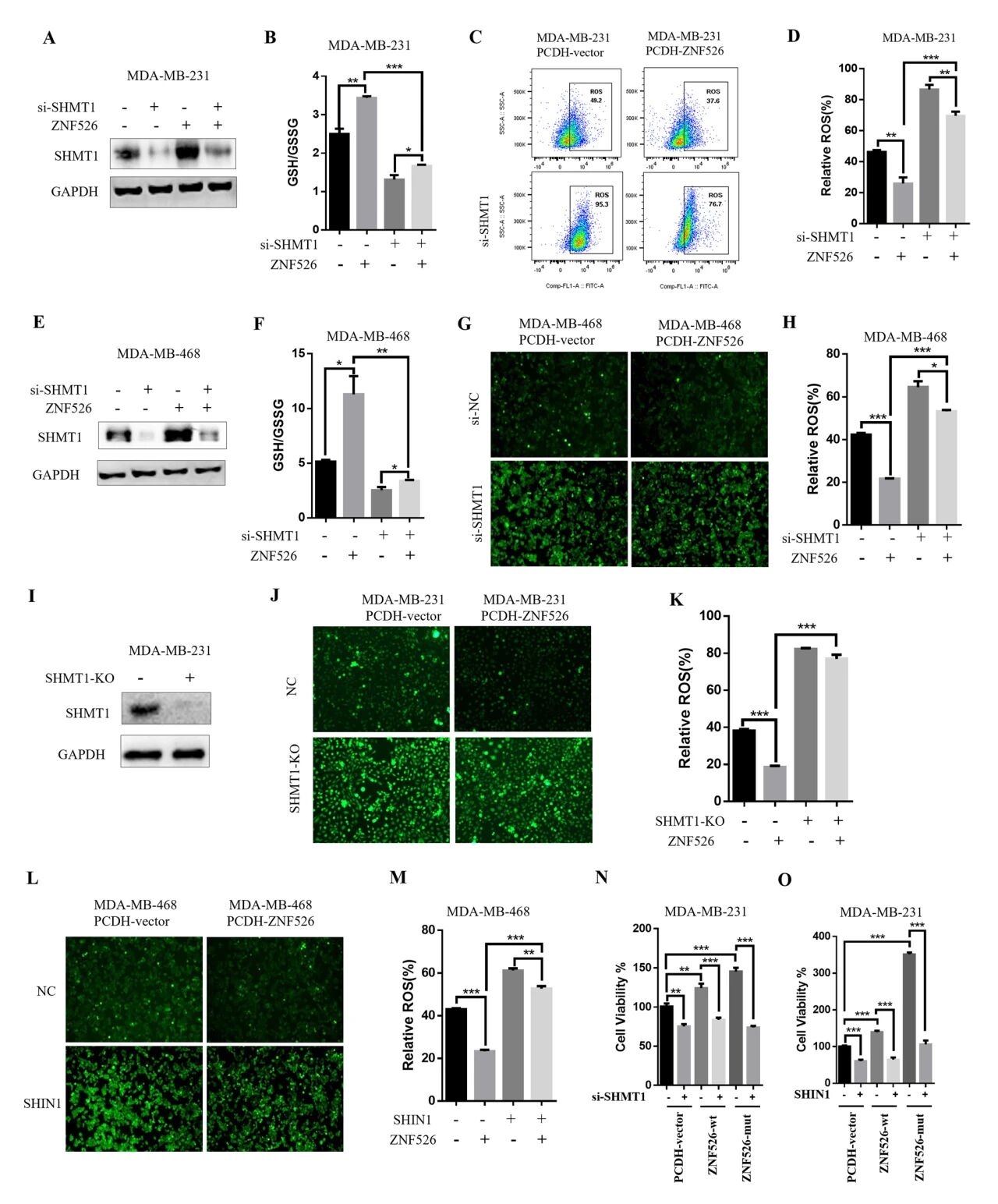 图6 SHMT1介导ZNF526的抗氧化和促生长作用
7. ZNF526促进异种移植瘤模型的肿瘤生长
用MDA-MB-231和MDA-MB-468细胞建立了小鼠异种移植模型。shZNF526明显抑制肿瘤生长,而过表达ZNF526则显著加速肿瘤进展,这与其促瘤功能一致。且与野生型ZNF526相比,表达ZNF526- v94a突变体的肿瘤表现出更强的生长优势。增殖标志物Ki67的免疫组化分析证实ZNF526正调控癌细胞增殖。体外观察,ZNF526敲低显著降低了SHMT1的表达,而ZNF526过表达则显著提高了SHMT1的表达水平。此外,ZNF526缺失导致显著的ROS积累,而ZNF526过表达抑制ROS水平。重要的是,GSH/GSSG比值在ZNF526敲除后显著降低,而在ZNF526过表达后升高,其中ZNF526- v94a突变体发挥了更明显的作用。进一步用特异性SHMT1抑制剂SHIN1处理过表达znf526的MDA-MB-468异种移植物小鼠。结果显示,SHIN1显著抑制了ZNF526过表达所带来的肿瘤生长优势,将肿瘤体积降低到与对照组相当的水平。与生长抑制一致,免疫组化分析显示,SHIN1处理后ki67阳性细胞显著减少。此外,SHIN1可有效诱导ROS积累。它还显著减弱了ZNF526过表达对ROS水平的抑制作用。用特异性SHMT1抑制剂SHIN1处理过表达znf526的MDA-MB-468异种移植物小鼠。结果显示,SHIN1显著抑制了ZNF526过表达所带来的肿瘤生长优势,将肿瘤体积降低到与对照组相当的水平。与生长抑制一致,免疫组化分析显示,SHIN1处理后ki67阳性细胞显著减少。此外,SHIN1可有效诱导ROS积累。它还显著减弱了ZNF526过表达对ROS水平的抑制作用。
图6 SHMT1介导ZNF526的抗氧化和促生长作用
7. ZNF526促进异种移植瘤模型的肿瘤生长
用MDA-MB-231和MDA-MB-468细胞建立了小鼠异种移植模型。shZNF526明显抑制肿瘤生长,而过表达ZNF526则显著加速肿瘤进展,这与其促瘤功能一致。且与野生型ZNF526相比,表达ZNF526- v94a突变体的肿瘤表现出更强的生长优势。增殖标志物Ki67的免疫组化分析证实ZNF526正调控癌细胞增殖。体外观察,ZNF526敲低显著降低了SHMT1的表达,而ZNF526过表达则显著提高了SHMT1的表达水平。此外,ZNF526缺失导致显著的ROS积累,而ZNF526过表达抑制ROS水平。重要的是,GSH/GSSG比值在ZNF526敲除后显著降低,而在ZNF526过表达后升高,其中ZNF526- v94a突变体发挥了更明显的作用。进一步用特异性SHMT1抑制剂SHIN1处理过表达znf526的MDA-MB-468异种移植物小鼠。结果显示,SHIN1显著抑制了ZNF526过表达所带来的肿瘤生长优势,将肿瘤体积降低到与对照组相当的水平。与生长抑制一致,免疫组化分析显示,SHIN1处理后ki67阳性细胞显著减少。此外,SHIN1可有效诱导ROS积累。它还显著减弱了ZNF526过表达对ROS水平的抑制作用。用特异性SHMT1抑制剂SHIN1处理过表达znf526的MDA-MB-468异种移植物小鼠。结果显示,SHIN1显著抑制了ZNF526过表达所带来的肿瘤生长优势,将肿瘤体积降低到与对照组相当的水平。与生长抑制一致,免疫组化分析显示,SHIN1处理后ki67阳性细胞显著减少。此外,SHIN1可有效诱导ROS积累。它还显著减弱了ZNF526过表达对ROS水平的抑制作用。
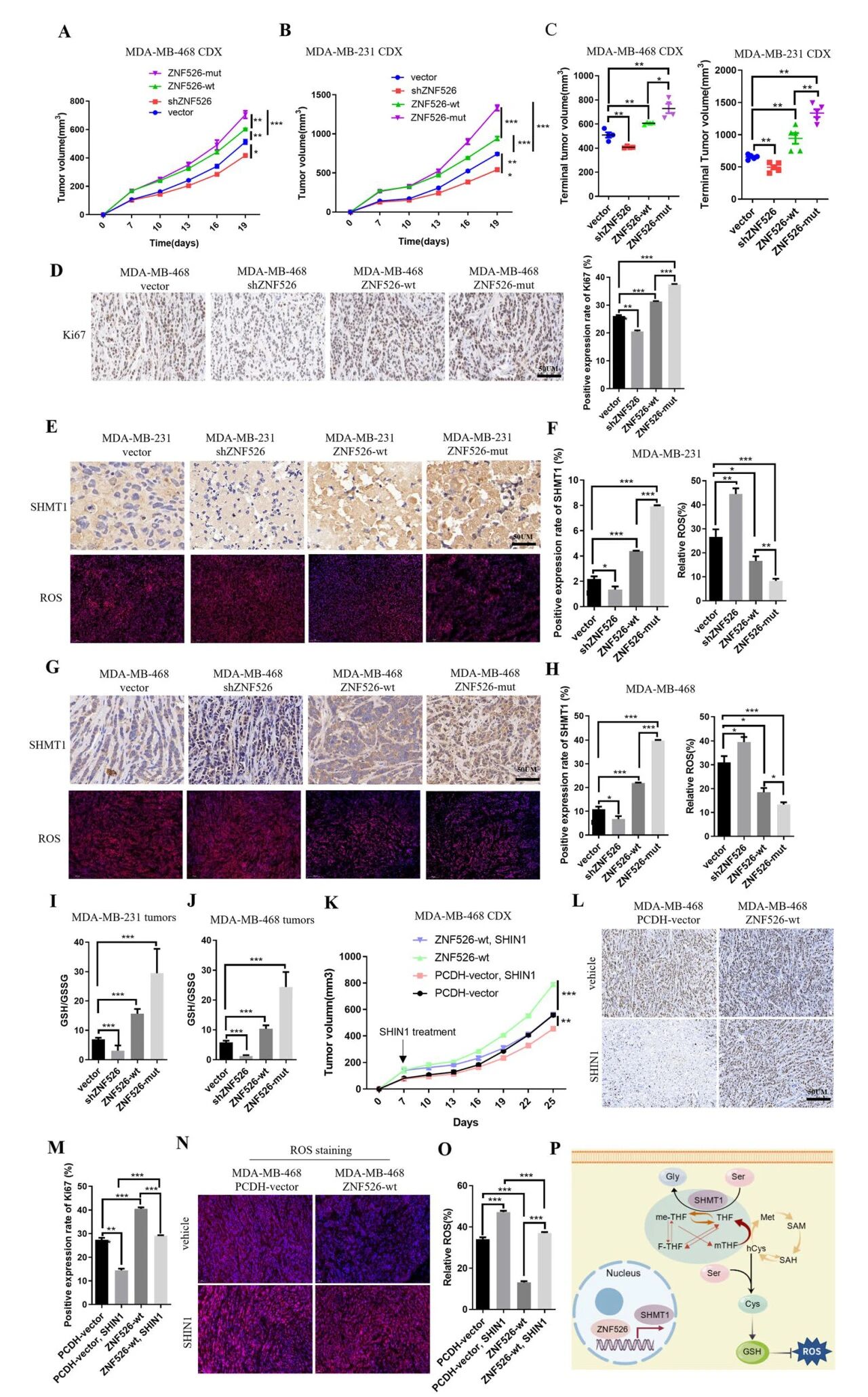 图7 ZNF526促进异种移植瘤模型的肿瘤生长
图7 ZNF526促进异种移植瘤模型的肿瘤生长
结论
ZNF526 是三阴性乳腺癌(TNBC)中氧化还原稳态的关键调节因子。功能获得性 Val94Ala 变体(rs3810151)可通过提高自身转录效率,显著增强 ZNF526 的致癌活性。在机制上,ZNF526 通过转录激活丝氨酸羟甲基转移酶 1(SHMT1),进而促进谷胱甘肽(GSH)的生物合成,为肿瘤细胞赋予氧化应激抗性,最终推动肿瘤增殖。这些发现揭示,ZNF526 是 TNBC 中核心的代谢调节因子,通过直接抑制 ZNF526 本身或其下游 SHMT1/GSH 信号轴,有望为 TNBC 治疗提供新的潜在靶点。中科优品推荐 【中科新生命】的多组学服务业务可为各位研究者提供详细的“实验设计、样本检测、生信分析、数据解读与挖掘”等工作,为您深入进行科学研究,发表高分文章,为后续临床转化奠定基础。
关于中科新生命
上海中科新生命生物科技有限公司(APTBIO)创立于 2004 年,由原中国科学院上海生命科学研究院蛋白质组研究中心孵化而来,是国内质谱多组学应用领域的开拓者。公司以 “AI + 质谱多组学” 双核驱动创新,构建智能化组学生态。拥有自主知识产权的质谱检测平台与 AI 大数据分析系统,聚焦科技服务、生物医药及大健康消费三大领域,为全球科研机构、医院、药企提供从基础研究到临床转化的一站式解决方案。融合多组学技术与人工智能,围绕生物标志物发掘、药物靶点筛选及个性化诊疗等方向,构建具有国际竞争力的组学数据库与算法模型,推动转化医学进程,加速创新药物研发,成为推动生命科学数字化升级的核心引领者。