上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Cell Metab | “四肢发达,头脑简单”实锤了!湘雅医院罗湘杭/彭慧团队揭示过度运动通过乳酸化引发认知功能障碍
51 人阅读发布时间:2025-12-10 10:16
 生命在于运动。运动已被广泛认可为预防疾病的有效方式,其中包括对大脑结构和功能的益处。然而,运动与健康的剂量-反应关系呈倒J形曲线。多项临床研究显示,过度的运动与认知能力下降之间存在关联。但该现象背后的机制仍然有太多的未知。
12月3日,中南大学湘雅医院罗湘杭/彭慧教授团队在Cell Metabolism(IF30.9)期刊在线发布了题为“Excessive vigorous exercise impairs cognitive function through a muscle-derived mitochondrial pretender”的研究论文。文章表明,过度运动诱导的乳酸积累会刺激肌肉分泌线粒体来源囊泡(MDVs),抑制海马线粒转运体并破坏其功能,从而引发认知障碍。
生命在于运动。运动已被广泛认可为预防疾病的有效方式,其中包括对大脑结构和功能的益处。然而,运动与健康的剂量-反应关系呈倒J形曲线。多项临床研究显示,过度的运动与认知能力下降之间存在关联。但该现象背后的机制仍然有太多的未知。
12月3日,中南大学湘雅医院罗湘杭/彭慧教授团队在Cell Metabolism(IF30.9)期刊在线发布了题为“Excessive vigorous exercise impairs cognitive function through a muscle-derived mitochondrial pretender”的研究论文。文章表明,过度运动诱导的乳酸积累会刺激肌肉分泌线粒体来源囊泡(MDVs),抑制海马线粒转运体并破坏其功能,从而引发认知障碍。

研究材料
UKB数据库数据;不同运动强度小鼠 技术路线
步骤1:确定过度运动与海马体突触功能损伤及认知障碍之间的关系;
步骤2:发现介导肌肉跨器官诱发海马体突触功能损伤的介质为线粒体来源囊泡(MDVs);
步骤3:分析过度运动期间乳酸诱导MDVs分泌的机制核心为ATF5的乳酸化修饰;
步骤4:确定MDVs中诱发海马体突触功能损伤的关键分子及机制;
步骤5:临床队列证明MDVs分泌与认知障碍之间的关联。
研究结果
1. 过度运动会导致海马体突触功能损伤及认知功能障碍
研究团队首先利用UKB数据库,分析发现更高的体育活动水平与较差的认知表现相关,且该观察性结论在小鼠的不同强度运动干预中得到验证。
认知障碍与海马体突触的功能丧失有关,因此研究团队进一步评估了不同运动强度小鼠的海马体变化。结果证实,过度运动小鼠的海马神经元表现出树突棘密度显著降低、突触密度降低和突触长度缩短的现象。这些结果证实了过度运动对突触结构和认知功能的有害影响。
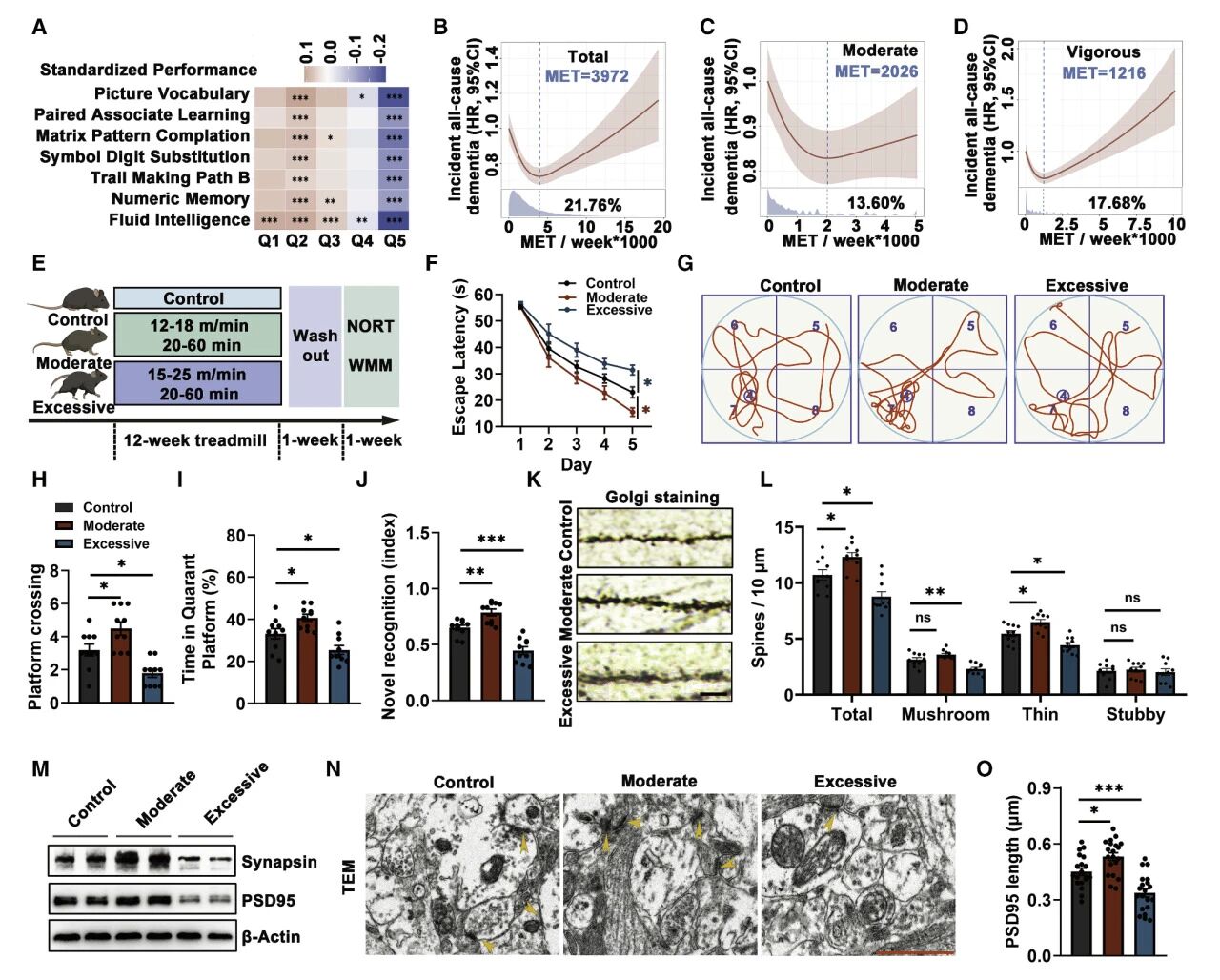 图1 过度运动会导致海马体突触缺损和认知功能障碍
2. 肌肉性MDVs会导致突触功能障碍和认知障碍
骨骼肌线粒体在运动过程中会经历大规模重塑。研究团队在过度运动小鼠的肌肉中发现线粒体出芽增加,且MDVs显著增加。随后研究团队的体内外试验均证明过度运动小鼠的MDVs可穿透血脑屏障并到达海马体区域,且主要定位于神经元。
进一步,作者评估了MDVs对认知障碍的影响。注射试验表明,过度运动小鼠的MDVs治疗会诱导认知下降,破坏了突触密度、形态、突触标记的表达和突触长度,而抑制肌肉性MDVs分泌可恢复受损的突触和认知功能。综上,过度运动小鼠的MDVs可破坏突触结构,并导致认知功能下降。
图1 过度运动会导致海马体突触缺损和认知功能障碍
2. 肌肉性MDVs会导致突触功能障碍和认知障碍
骨骼肌线粒体在运动过程中会经历大规模重塑。研究团队在过度运动小鼠的肌肉中发现线粒体出芽增加,且MDVs显著增加。随后研究团队的体内外试验均证明过度运动小鼠的MDVs可穿透血脑屏障并到达海马体区域,且主要定位于神经元。
进一步,作者评估了MDVs对认知障碍的影响。注射试验表明,过度运动小鼠的MDVs治疗会诱导认知下降,破坏了突触密度、形态、突触标记的表达和突触长度,而抑制肌肉性MDVs分泌可恢复受损的突触和认知功能。综上,过度运动小鼠的MDVs可破坏突触结构,并导致认知功能下降。
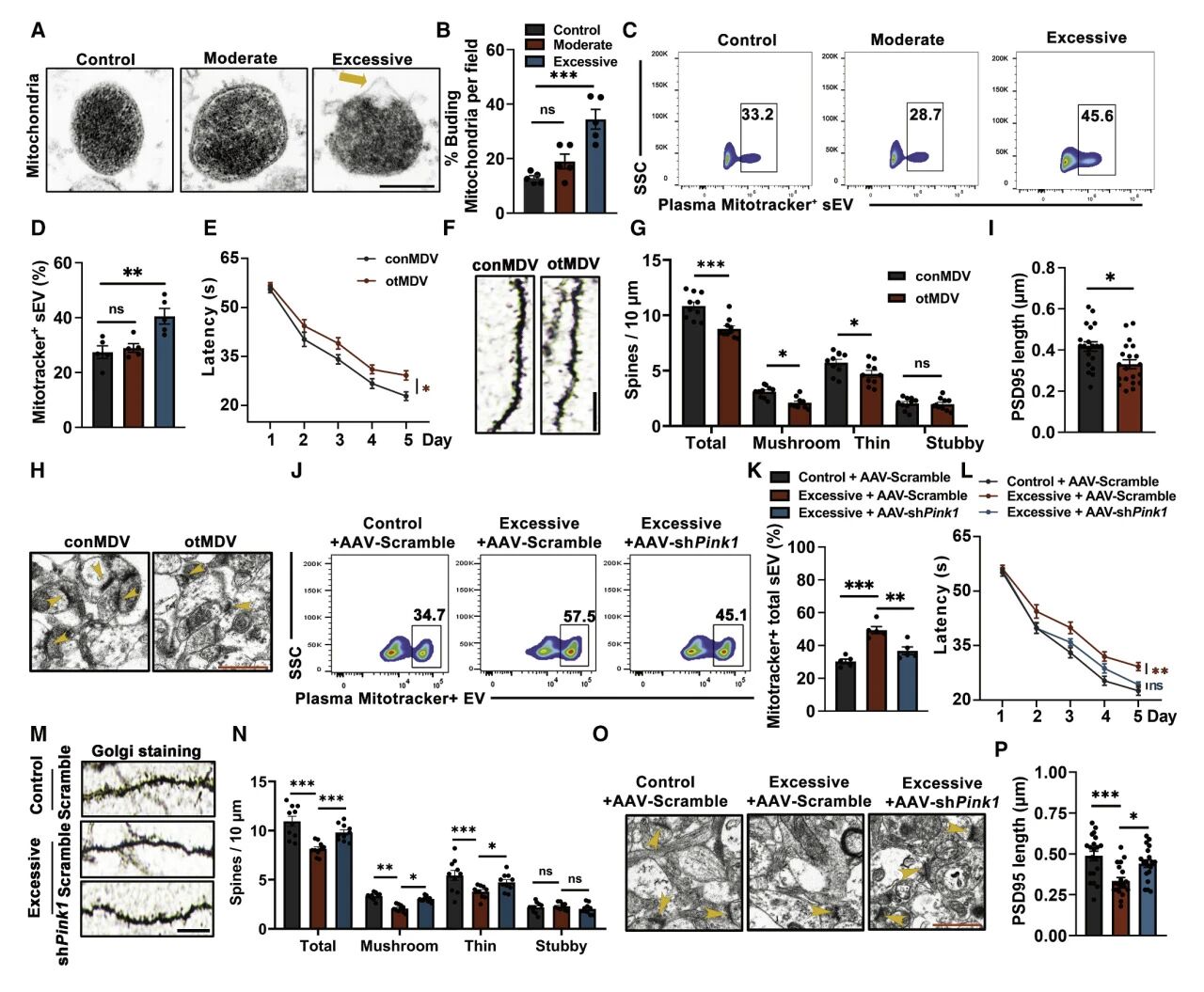 图2 肌肉性MDVs会导致突触功能障碍和认知障碍
3. MDVs以表面标记PAF和富含线粒体DNA为特征,受ATF5乳酸化修饰控制
对正常和过度运动小鼠肌肉性MDVs进行蛋白质组学分析,发现PAF为过度运动小鼠上调最突出的蛋白。此外相比于正常小鼠的肌肉性MDVs,过度运动小鼠的MDVs中富含更高水平的线粒体DNA。
进一步研究促进MDVs分泌的机制,研究团队发现,乳酸而非其它因素促进了体内的MDVs水平。此外,高浓度的乳酸注射诱导的小鼠认知功能下降显著,而LDHA的抑制可逆转高乳酸水平带来的影响,证明某些蛋白的乳酸化修饰促进MDVs的生成和分泌。在所有被乳酸化修饰的蛋白中,ATF5被报道参与调控线粒体在不同刺激下的稳态。随后基于点突变和CoIP试验,研究团队证明ATF5的乳酸化修饰驱动线粒体蛋白酶CLPP的降解,进而促进了MDVs的生成和分泌。
图2 肌肉性MDVs会导致突触功能障碍和认知障碍
3. MDVs以表面标记PAF和富含线粒体DNA为特征,受ATF5乳酸化修饰控制
对正常和过度运动小鼠肌肉性MDVs进行蛋白质组学分析,发现PAF为过度运动小鼠上调最突出的蛋白。此外相比于正常小鼠的肌肉性MDVs,过度运动小鼠的MDVs中富含更高水平的线粒体DNA。
进一步研究促进MDVs分泌的机制,研究团队发现,乳酸而非其它因素促进了体内的MDVs水平。此外,高浓度的乳酸注射诱导的小鼠认知功能下降显著,而LDHA的抑制可逆转高乳酸水平带来的影响,证明某些蛋白的乳酸化修饰促进MDVs的生成和分泌。在所有被乳酸化修饰的蛋白中,ATF5被报道参与调控线粒体在不同刺激下的稳态。随后基于点突变和CoIP试验,研究团队证明ATF5的乳酸化修饰驱动线粒体蛋白酶CLPP的降解,进而促进了MDVs的生成和分泌。
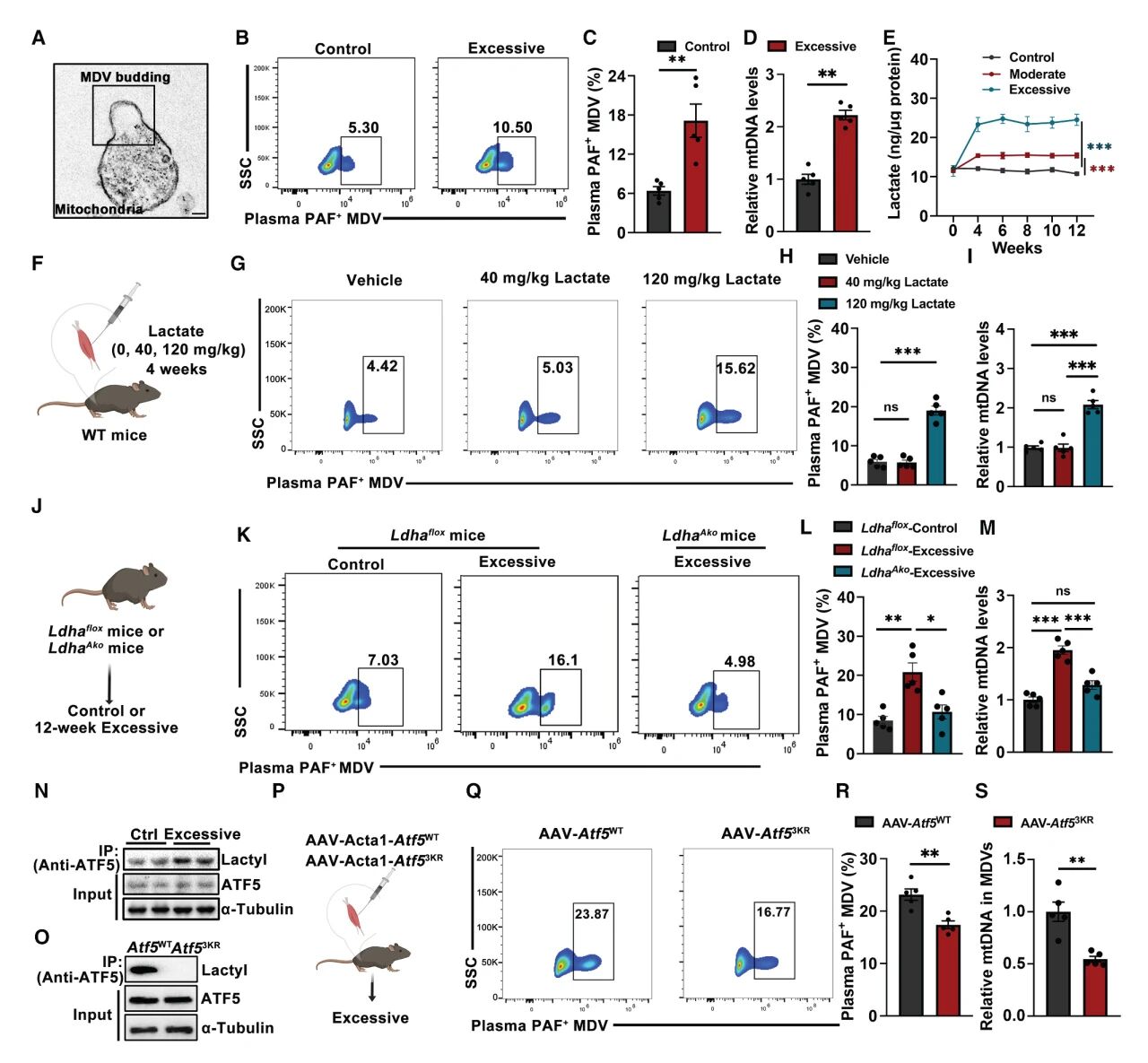 图3 MDVs的分子特征及受调控机制
4. MDVs通过PAF锚定神经元突触,其mtDNA通过cGAS-STING干扰线粒体向突触运输
鉴于PAF为过度运动小鼠MDVs上调最显著的表面标记蛋白,研究团队继续研究PAF在突触功能损伤中的作用。通过PAF中和抗体和PAF缺陷型小鼠,证明了PAF在突触功能损伤和认知障碍中的核心作用。免疫沉淀和Snph敲低试验结果表明,MDVs在神经元突触上的锚定依赖于其表面标记蛋白PAF与海马神经元SNPH之间的结合。
已有研究表明,线粒体DNA能激活cGAS-STING信号通路。为了确定该信号通路是否参与神经元突触的结构和功能损伤,研究团队通过抑制MDVs中的mtDNA释放和STING活性,观察了cGAS-STING信号通路和控制神经元线粒体在突触部位分布的马达蛋白KIF5的变化,以及突触ATP的浓度变化。发现过度运动产生的MDVs通过释放mtDNA和随后的cGAS-STING信号通路激活,抑制了KIF5的表达和随后的ATP产生,进而抑制突触的结构和功能。
图3 MDVs的分子特征及受调控机制
4. MDVs通过PAF锚定神经元突触,其mtDNA通过cGAS-STING干扰线粒体向突触运输
鉴于PAF为过度运动小鼠MDVs上调最显著的表面标记蛋白,研究团队继续研究PAF在突触功能损伤中的作用。通过PAF中和抗体和PAF缺陷型小鼠,证明了PAF在突触功能损伤和认知障碍中的核心作用。免疫沉淀和Snph敲低试验结果表明,MDVs在神经元突触上的锚定依赖于其表面标记蛋白PAF与海马神经元SNPH之间的结合。
已有研究表明,线粒体DNA能激活cGAS-STING信号通路。为了确定该信号通路是否参与神经元突触的结构和功能损伤,研究团队通过抑制MDVs中的mtDNA释放和STING活性,观察了cGAS-STING信号通路和控制神经元线粒体在突触部位分布的马达蛋白KIF5的变化,以及突触ATP的浓度变化。发现过度运动产生的MDVs通过释放mtDNA和随后的cGAS-STING信号通路激活,抑制了KIF5的表达和随后的ATP产生,进而抑制突触的结构和功能。
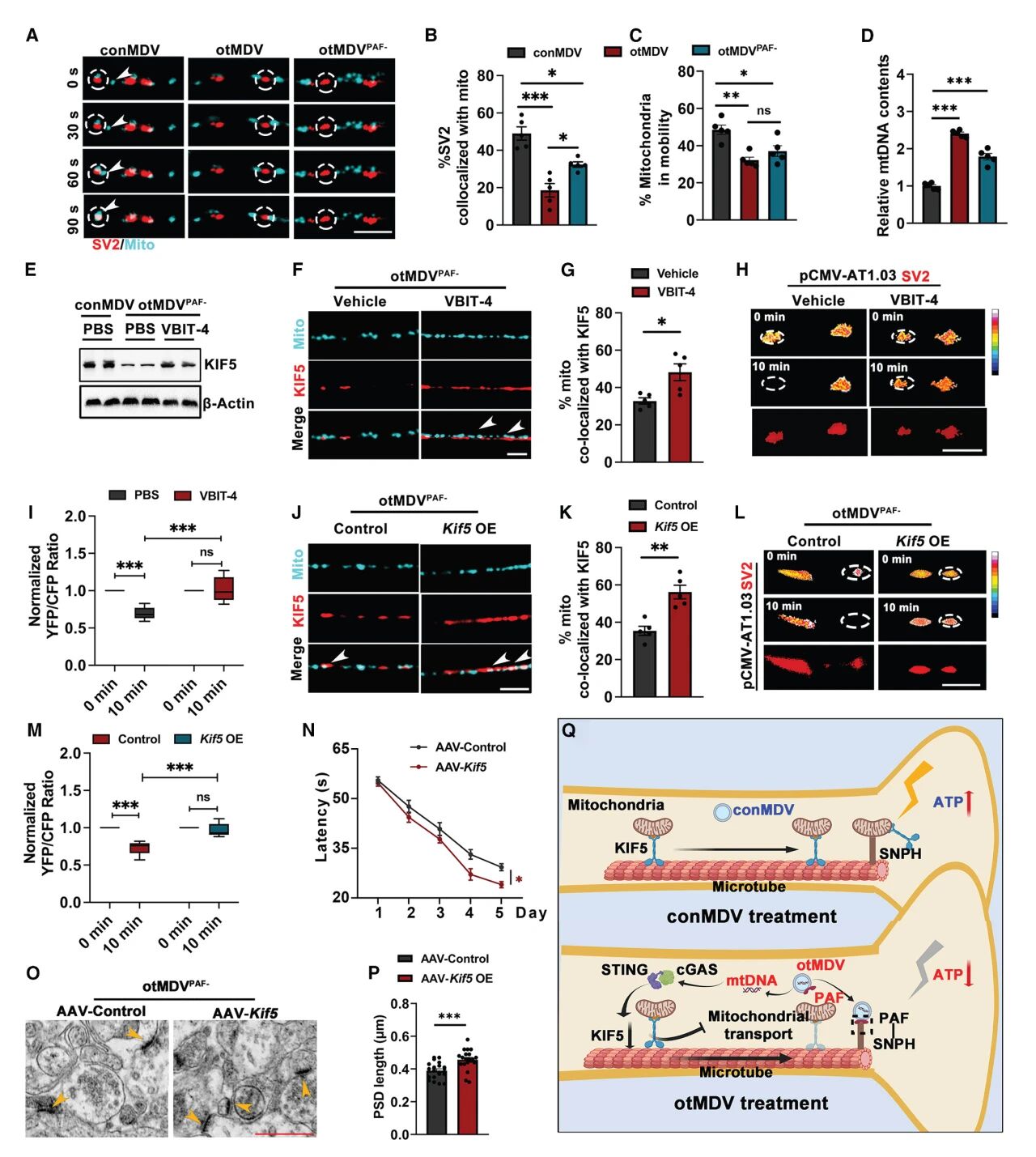 图4 MDVs mtDNA通过cGAS-STING干扰线粒体向突触运输
5. 过度运动产生的MDVs在临床上与认知障碍相关
研究团队最后探讨了过度运动产生的MDVs在人类中的意义。在招募的第一队运动人群中,循环的乳酸水平与PAF-MDVs之间观察到显著正相关。在另一项随机对照试验中,高强度运动组的PAF-MDVs水平和MDVs mtDNA水平显著高于对照组,且表现出较低的智力评分和数字记忆能力。这些结果表明PAF-MDVs可以作为评估人类过度运动相关认知障碍风险的有力指标。
图4 MDVs mtDNA通过cGAS-STING干扰线粒体向突触运输
5. 过度运动产生的MDVs在临床上与认知障碍相关
研究团队最后探讨了过度运动产生的MDVs在人类中的意义。在招募的第一队运动人群中,循环的乳酸水平与PAF-MDVs之间观察到显著正相关。在另一项随机对照试验中,高强度运动组的PAF-MDVs水平和MDVs mtDNA水平显著高于对照组,且表现出较低的智力评分和数字记忆能力。这些结果表明PAF-MDVs可以作为评估人类过度运动相关认知障碍风险的有力指标。
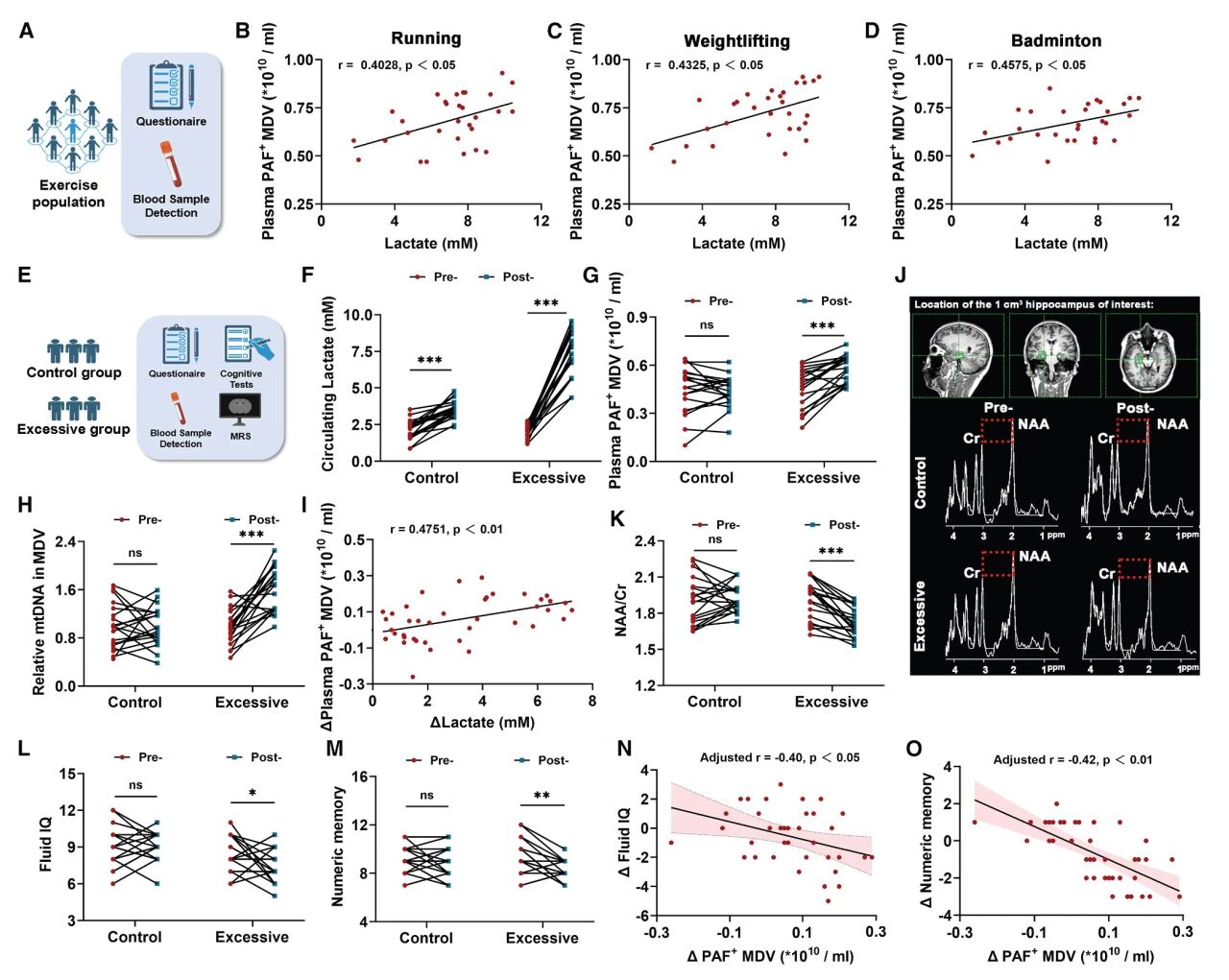 图5 过度运动产生的MDVs在临床上与认知障碍相关
图5 过度运动产生的MDVs在临床上与认知障碍相关
总结
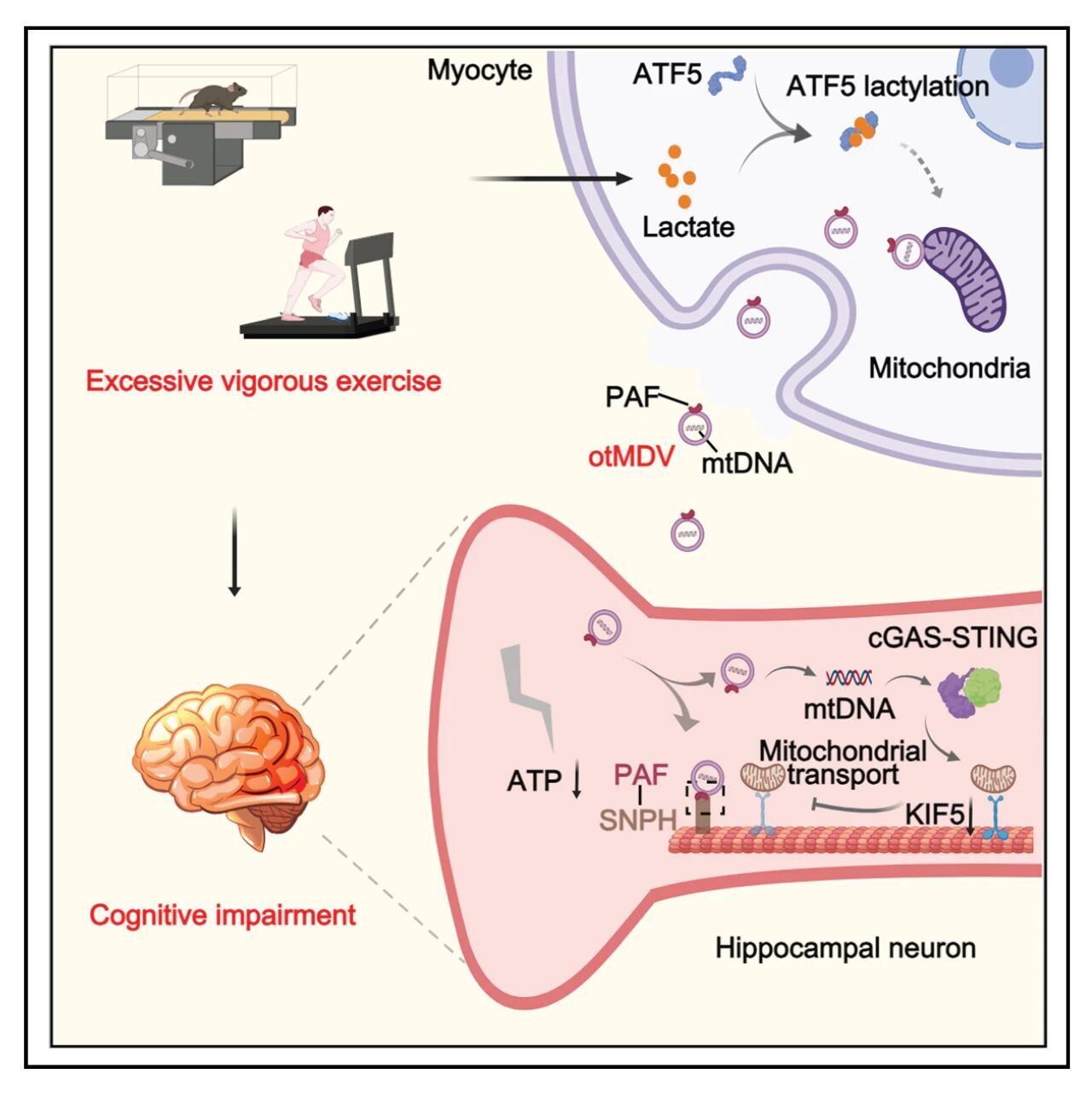
该研究解释了过度运动导致认知功能障碍背后的分子机制。具体来说,过度运动积累的大量乳酸通过对ATF5的乳酸化修饰促使富含mtDNA且高表达PAF的MDVs从肌肉组织分泌,而PAF通过与海马体神经元的SNPH结合使得MDVs得以锚定在神经元上。MDVs内的mtDNA通过激活cGAS-STING信号通进而抑制KIF5的表达,从而抑制神经元的线粒体向突触传递,进而降低突触的ATP含量,导致突触的结构和功能损伤,诱导认知功能障碍。
中科优品推荐 【中科新生命】奥斯卡DIA乳酸化,位点检测深度破74000,助力创新研究!更有下游机制挖掘思路及乳酸化位点验证等全套解决方案!现欢迎感兴趣的老师咨询!

 滑动图片查看更多>>>
滑动图片查看更多>>>
关于中科新生命
上海中科新生命生物科技有限公司(APTBIO)创立于 2004 年,由原中国科学院上海生命科学研究院蛋白质组研究中心孵化而来,是国内质谱多组学应用领域的开拓者。公司以 “AI + 质谱多组学” 双核驱动创新,构建智能化组学生态。拥有自主知识产权的质谱检测平台与 AI 大数据分析系统,聚焦科技服务、生物医药及大健康消费三大领域,为全球科研机构、医院、药企提供从基础研究到临床转化的一站式解决方案。融合多组学技术与人工智能,围绕生物标志物发掘、药物靶点筛选及个性化诊疗等方向,构建具有国际竞争力的组学数据库与算法模型,推动转化医学进程,加速创新药物研发,成为推动生命科学数字化升级的核心引领者。