上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
肿瘤乳酸化:高分文章“收割机”!近半年国人4项研究破译其介导铁死亡及耐药密码!
343 人阅读发布时间:2025-06-16 13:55
 乳酸化和铁死亡是近些年国自然研究的热点之一。乳酸化是一种蛋白质翻译后修饰,目前已被证实在细胞中广泛存在,是细胞代谢物乳酸的重要作用方式之一。由于肿瘤细胞乳酸堆积这一重要代谢重编程特征,使得乳酸化在肿瘤研究领域获得了最广泛的关注,也产出了最多的研究成果,涉及肿瘤发生发展及耐药等各方面研究。铁死亡是一种铁依赖性的,区别于细胞凋亡、细胞自噬的新型细胞程序性死亡方式,已被报道与肿瘤细胞的代谢状态密切相关。
小编在梳理近半年肿瘤领域的乳酸化研究文章时发现,有多篇研究报道了乳酸化参与的肿瘤铁死亡调控或/和肿瘤耐药机制。下面就让我们依次来看看吧!
乳酸化和铁死亡是近些年国自然研究的热点之一。乳酸化是一种蛋白质翻译后修饰,目前已被证实在细胞中广泛存在,是细胞代谢物乳酸的重要作用方式之一。由于肿瘤细胞乳酸堆积这一重要代谢重编程特征,使得乳酸化在肿瘤研究领域获得了最广泛的关注,也产出了最多的研究成果,涉及肿瘤发生发展及耐药等各方面研究。铁死亡是一种铁依赖性的,区别于细胞凋亡、细胞自噬的新型细胞程序性死亡方式,已被报道与肿瘤细胞的代谢状态密切相关。
小编在梳理近半年肿瘤领域的乳酸化研究文章时发现,有多篇研究报道了乳酸化参与的肿瘤铁死亡调控或/和肿瘤耐药机制。下面就让我们依次来看看吧!
文章案例 案例1
HDAC1乳酸化与结直肠癌中铁死亡抗性有关
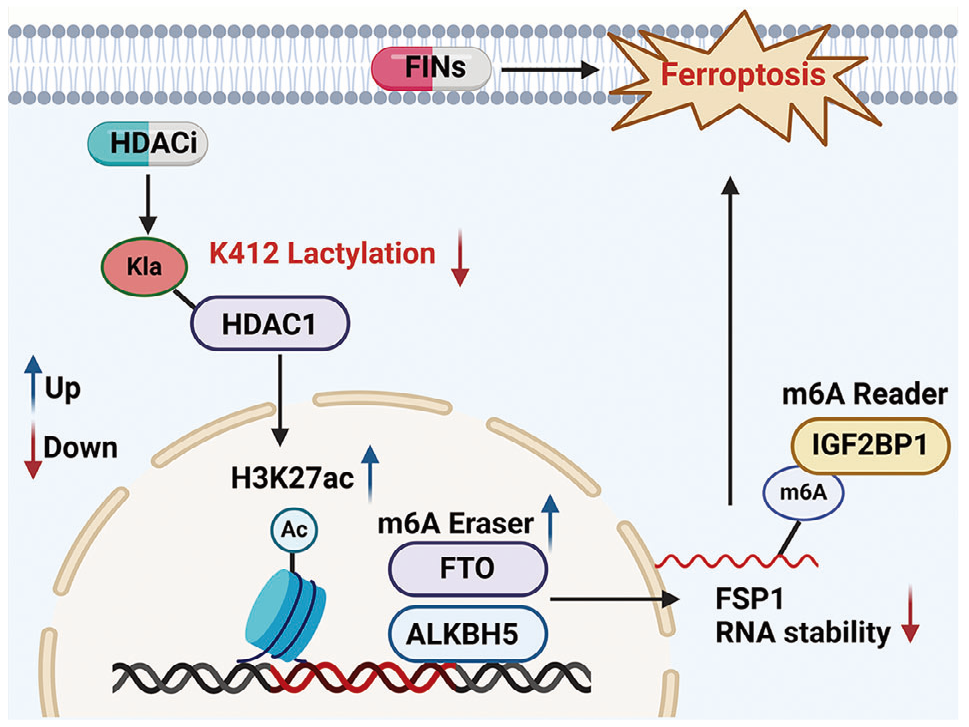
 2025年1月,南京大学和复旦大学的研究团队合作在Advanced Science(IF=14.3)上发表了题为“Lactylation of HDAC1 Confers Resistance to Ferroptosis in Colorectal Cancer”的研究论文。 该研究揭示HDAC抑制剂调控HDAC1 K412乳酸化增强了结直肠癌(CRC)对铁死亡的敏感性。
机制上,HDACi特异性靶向HDAC1,并促进脂肪质量和肥胖相关基因(FTO)、RNA m6A去甲基化酶 ALKBH5基因的H3K27ac修饰,从而显著激活FTO和ALKBH5。FTO和ALKBH5的激活减少了铁死亡抑制蛋白1(FSP1) mRNA的m6A修饰,导致其降解。HDAC1 K412乳酸化对于铁死亡的调节至关重要。HDAC1抑制剂SAHA和TSA显著降低了HDAC1 K412乳酸化,增强了对铁死亡敏感性。总之,研究表明HDACi通过降低HDAC1 K412乳酸化来增强CRC对铁死亡的敏感性,并且HDACi与铁死亡诱导剂的联合使用可能是CRC的一种有前景的治疗策略。
2025年1月,南京大学和复旦大学的研究团队合作在Advanced Science(IF=14.3)上发表了题为“Lactylation of HDAC1 Confers Resistance to Ferroptosis in Colorectal Cancer”的研究论文。 该研究揭示HDAC抑制剂调控HDAC1 K412乳酸化增强了结直肠癌(CRC)对铁死亡的敏感性。
机制上,HDACi特异性靶向HDAC1,并促进脂肪质量和肥胖相关基因(FTO)、RNA m6A去甲基化酶 ALKBH5基因的H3K27ac修饰,从而显著激活FTO和ALKBH5。FTO和ALKBH5的激活减少了铁死亡抑制蛋白1(FSP1) mRNA的m6A修饰,导致其降解。HDAC1 K412乳酸化对于铁死亡的调节至关重要。HDAC1抑制剂SAHA和TSA显著降低了HDAC1 K412乳酸化,增强了对铁死亡敏感性。总之,研究表明HDACi通过降低HDAC1 K412乳酸化来增强CRC对铁死亡的敏感性,并且HDACi与铁死亡诱导剂的联合使用可能是CRC的一种有前景的治疗策略。
案例2
NSUN2乳酸化通过增强GCLC依赖的谷胱甘肽合成驱动癌细胞铁死亡
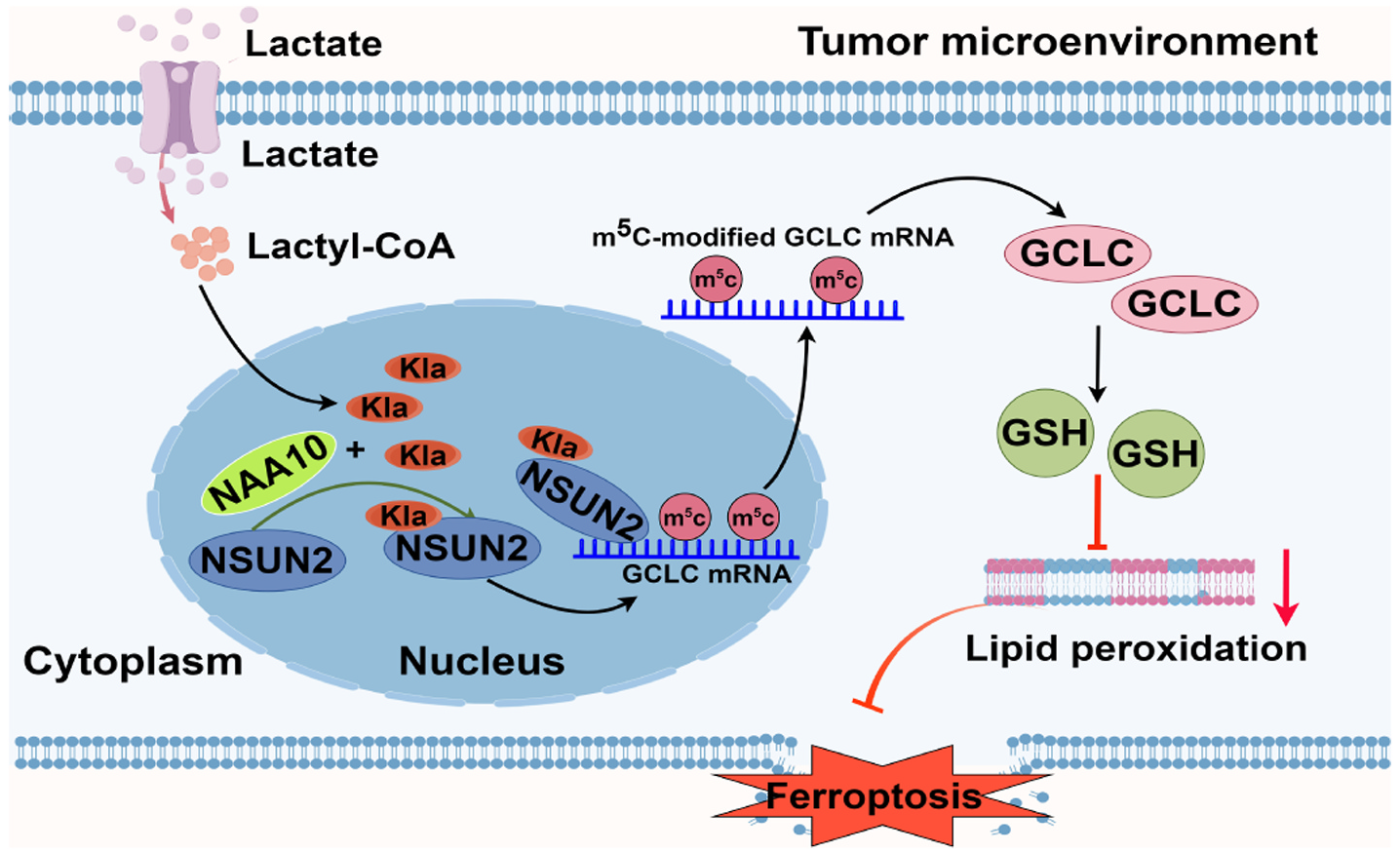
 2024年12月,中国科学院大学的研究团队在Redox Biology(IF=10.7)上发表了题为“NSUN2 lactylation drives cancer cell resistance to ferroptosis through enhancing GCLC-dependent glutathione synthesis”的研究论文,揭示了乳酸化介导的RNA m5C甲基转移酶NSUN2对肿瘤微环境的酸性条件的响应及调控肿瘤细胞生存的机制。
具体来说,NSUN2的活性通过乳酸介导的508位赖氨酸乳酸化而增强,进而靶向谷氨酸-半胱氨酸连接酶催化亚基(GCLC)mRNA,促进GCLC m5C形成和并增强mRNA稳定性。激活的GCLC诱导细胞内谷胱甘肽(GSH)水平升高,并伴随脂质过氧化减少以及对阿霉素(Dox)诱导的铁死亡的耐药表型。当NSUN2 508K突变为R或 GCLC C突变为A,NSUN2乳酸化-GCLC-GSH通路的作用几乎消失。研究者进一步鉴定N-α-乙酰转移酶10(NAA10)为NSUN2的乳酰基转移酶,乳酸处理显著增强它们之间的结合以及随后的NSUN2激活。总体,该研究阐明了NAA10-NSUN2-GCLC信号轴在酸性条件下强烈拮抗铁死亡,因此,靶向NSUN2乳酸化可能是改善癌症患者预后的有效策略。
2024年12月,中国科学院大学的研究团队在Redox Biology(IF=10.7)上发表了题为“NSUN2 lactylation drives cancer cell resistance to ferroptosis through enhancing GCLC-dependent glutathione synthesis”的研究论文,揭示了乳酸化介导的RNA m5C甲基转移酶NSUN2对肿瘤微环境的酸性条件的响应及调控肿瘤细胞生存的机制。
具体来说,NSUN2的活性通过乳酸介导的508位赖氨酸乳酸化而增强,进而靶向谷氨酸-半胱氨酸连接酶催化亚基(GCLC)mRNA,促进GCLC m5C形成和并增强mRNA稳定性。激活的GCLC诱导细胞内谷胱甘肽(GSH)水平升高,并伴随脂质过氧化减少以及对阿霉素(Dox)诱导的铁死亡的耐药表型。当NSUN2 508K突变为R或 GCLC C突变为A,NSUN2乳酸化-GCLC-GSH通路的作用几乎消失。研究者进一步鉴定N-α-乙酰转移酶10(NAA10)为NSUN2的乳酰基转移酶,乳酸处理显著增强它们之间的结合以及随后的NSUN2激活。总体,该研究阐明了NAA10-NSUN2-GCLC信号轴在酸性条件下强烈拮抗铁死亡,因此,靶向NSUN2乳酸化可能是改善癌症患者预后的有效策略。
案例3
LSD1乳酸化参与的BRAFi/ MEKi耐药黑色素瘤作用机制
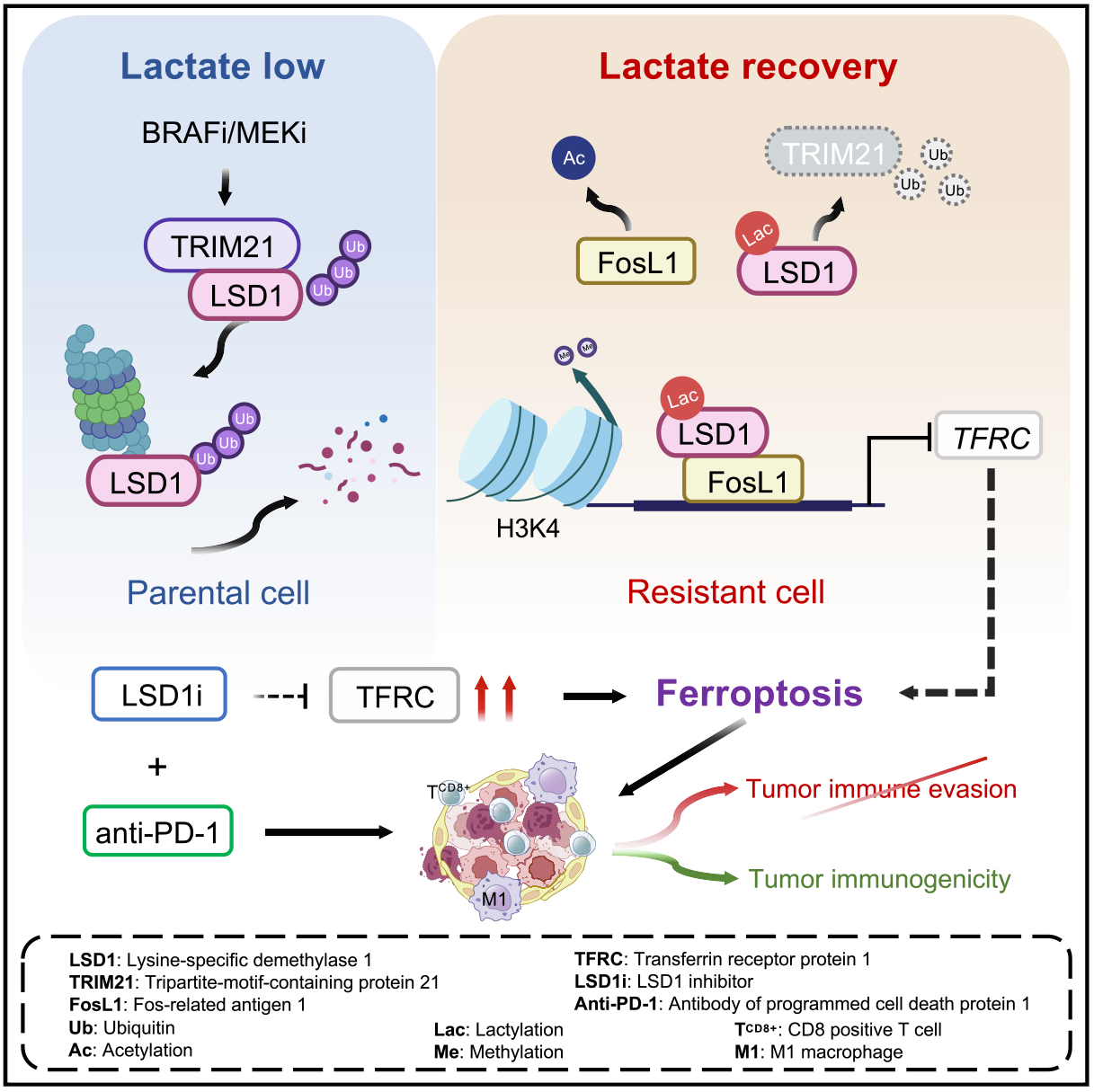
 2025年3月,厦门大学和空军军医大学的研究团队联合在Developmental Cell(IF=10.7)上发表了题为“Lactylation of LSD1 is an acquired epigenetic vulnerability of BRAFi/MEKi-resistant melanoma”的研究论文,揭示了乳酸代谢重编程驱动赖氨酸特异性去甲基化酶1(LSD1)乳酸化作为黑色素瘤靶向耐药的分子机制。
机制上,BRAFi/MEKi耐药黑色素瘤细胞中积累的乳酸诱导LSD1的乳酸化,并促进其与Fos相关抗原1(FosL1)的相互作用,防止其被泛素E3连接酶TRIM21降解,并选择性增强其基因组富集。乳酸化的LSD1与FosL1共同指导基因转录,通过干扰转铁蛋白受体1(TFRC)介导的铁摄取来抑制铁死亡。抑制LSD1将激活铁死亡,当与免疫疗法联合时,药物耐药小鼠黑色素瘤的显著退化。总体来说,本研究强调了乳酸化在BRAFi/MEKi耐药黑色素瘤中的关键作用,提供了一种克服靶向治疗和免疫疗法的耐药性的潜在策略。
2025年3月,厦门大学和空军军医大学的研究团队联合在Developmental Cell(IF=10.7)上发表了题为“Lactylation of LSD1 is an acquired epigenetic vulnerability of BRAFi/MEKi-resistant melanoma”的研究论文,揭示了乳酸代谢重编程驱动赖氨酸特异性去甲基化酶1(LSD1)乳酸化作为黑色素瘤靶向耐药的分子机制。
机制上,BRAFi/MEKi耐药黑色素瘤细胞中积累的乳酸诱导LSD1的乳酸化,并促进其与Fos相关抗原1(FosL1)的相互作用,防止其被泛素E3连接酶TRIM21降解,并选择性增强其基因组富集。乳酸化的LSD1与FosL1共同指导基因转录,通过干扰转铁蛋白受体1(TFRC)介导的铁摄取来抑制铁死亡。抑制LSD1将激活铁死亡,当与免疫疗法联合时,药物耐药小鼠黑色素瘤的显著退化。总体来说,本研究强调了乳酸化在BRAFi/MEKi耐药黑色素瘤中的关键作用,提供了一种克服靶向治疗和免疫疗法的耐药性的潜在策略。
 案例4
案例4
升高的蛋白乳酸化促进胰腺导管腺癌的免疫抑制微环境和治疗耐药性
 2025年1月,浙江大学医学院附属第一医院的研究团队在Journal of Clinical Investigation(IF=13.3)上发表了题为“Elevated protein lactylation promotes immunosuppressive microenvironment and therapeutic resistance in pancreatic ductal adenocarcinoma”的研究论文,揭示了乳酸化在胰腺导管腺癌(PDAC)免疫抑制和治疗抗性中的作用。
具体来说,研究者检测患者对氟代脱氧葡萄糖(18F-FDG)摄入后发现,PDAC中全局蛋白质乳酸化增加与更差的免疫治疗临床结果相关。通过抑制糖酵解或KRAS突变胰腺肿瘤中的乳酸生产,重塑了肿瘤免疫微环境(TME),从而增加了它们对免疫检查点阻断(ICB)疗法的敏感性。在胰腺肿瘤细胞中,乳酸诱导ENSA的K63发生乳酸化,这是触发STAT3/CCL2信号传导的关键步骤。因此,肿瘤细胞分泌的CCL2水平升高促进了肿瘤相关巨噬细胞(TAM)在TME中的招募。高水平的乳酸还通过ENSA-STAT3信号传导驱动TAM的转录重编程,促进免疫抑制环境。靶向ENSA K63乳酸化或CCL2增强了小鼠和人源化胰腺肿瘤模型中ICB疗法的疗效。总之,乳酸化水平的升高重塑了TME,并促进了PDAC中免疫治疗的抵抗。靶向ENSA K63乳酸化或CCL2的治疗策略或可增强胰腺癌免疫治疗效果。
2025年1月,浙江大学医学院附属第一医院的研究团队在Journal of Clinical Investigation(IF=13.3)上发表了题为“Elevated protein lactylation promotes immunosuppressive microenvironment and therapeutic resistance in pancreatic ductal adenocarcinoma”的研究论文,揭示了乳酸化在胰腺导管腺癌(PDAC)免疫抑制和治疗抗性中的作用。
具体来说,研究者检测患者对氟代脱氧葡萄糖(18F-FDG)摄入后发现,PDAC中全局蛋白质乳酸化增加与更差的免疫治疗临床结果相关。通过抑制糖酵解或KRAS突变胰腺肿瘤中的乳酸生产,重塑了肿瘤免疫微环境(TME),从而增加了它们对免疫检查点阻断(ICB)疗法的敏感性。在胰腺肿瘤细胞中,乳酸诱导ENSA的K63发生乳酸化,这是触发STAT3/CCL2信号传导的关键步骤。因此,肿瘤细胞分泌的CCL2水平升高促进了肿瘤相关巨噬细胞(TAM)在TME中的招募。高水平的乳酸还通过ENSA-STAT3信号传导驱动TAM的转录重编程,促进免疫抑制环境。靶向ENSA K63乳酸化或CCL2增强了小鼠和人源化胰腺肿瘤模型中ICB疗法的疗效。总之,乳酸化水平的升高重塑了TME,并促进了PDAC中免疫治疗的抵抗。靶向ENSA K63乳酸化或CCL2的治疗策略或可增强胰腺癌免疫治疗效果。
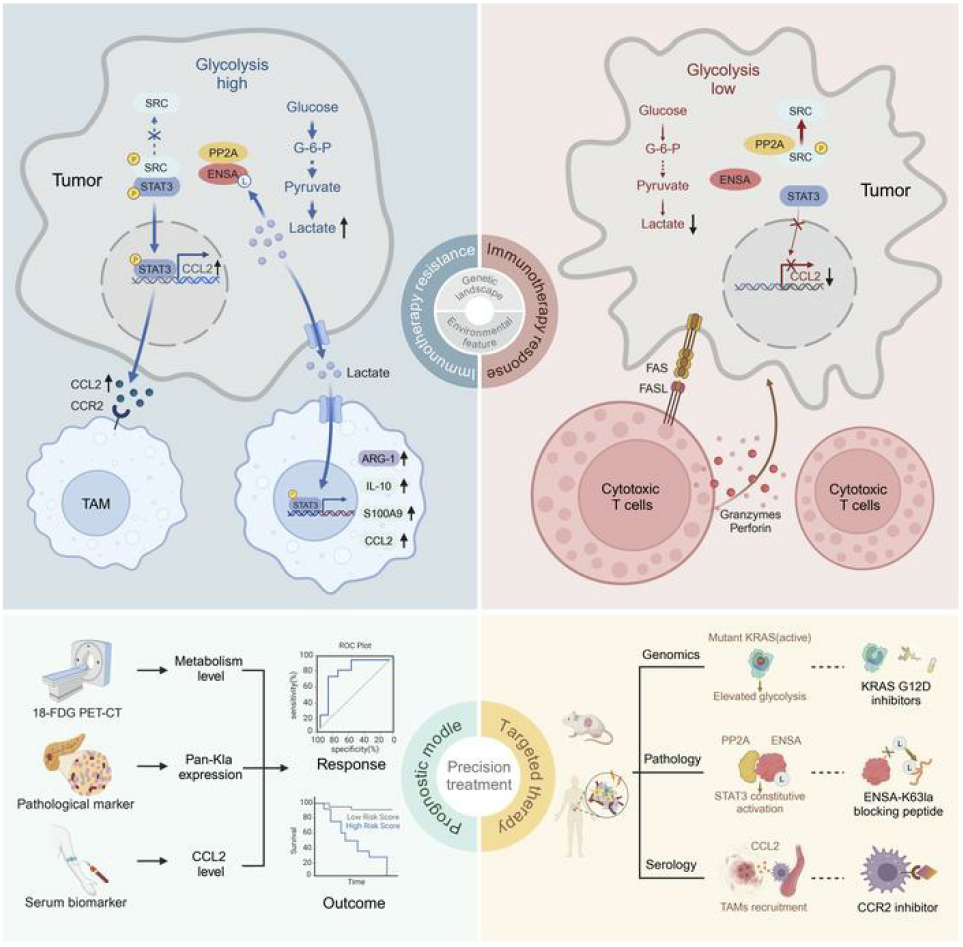
研究总结 以上4篇文章了揭示乳酸化在肿瘤铁死亡与耐药中的关键作用。文章1发现HDAC1乳酸化增强结直肠癌对铁死亡的抗性,HDAC抑制剂通过降低其乳酸化可增强铁死亡敏感性。文章2表明NSUN2乳酸化通过增强GCLC依赖的谷胱甘肽合成,使癌细胞对铁死亡产生耐药。文章3指出BRAFi/MEKi耐药黑色素瘤中,乳酸诱导LSD1乳酸化,干扰铁摄取抑制铁死亡。文章4发现胰腺导管腺癌中蛋白乳酸化增加,促进免疫抑制微环境形成和治疗耐药。这些研究所揭示的具体机制加深了我们对蛋白质乳酸化作用的理解,也为相关肿瘤耐药及更好的治疗带来新的启发。
中科新生命乳酸化相关检测服务 1 乳酸化泛抗体检测样本中总乳酸化丰度 2 高通量乳酸化位点检测:奥斯卡DIA乳酸化 目前实测项目最高检出位点数已突破7.4W!点击以下链接了解乳酸化研究背景、奥斯卡DIA乳酸化实验流程&产品特色。 3 验证:乳酸化位点特异性抗体定制 中科新生命联合战略合作方杭州微米生物,提供针对具体蛋白乳酸化位点的特异性抗体定制开发服务,欢迎感兴趣的老师咨询!
中科优品推荐 【中科新生命】奥斯卡DIA乳酸化,位点检测深度破74000,助力创新研究!更有下游机制挖掘思路及乳酸化位点验证等全套解决方案!现特别推出满五送一活动,额外惊喜赠送乳酸化泛抗体,欢迎感兴趣的老师咨询!