上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
项目文章Hepatology | 蒋树龙、马长林联合虞甬团队揭示肝细胞癌脂代谢重编程新机制
1324 人阅读发布时间:2025-02-27 09:54
 肝细胞癌(HCC)是全球范围内引发癌症相关死亡的第二大主要病因,其具有高度异质性,这一特性致使临床上缺乏有效的治疗手段。现阶段,肝细胞癌的治疗选择极为有限。不仅如此,其在全球范围内的发病率还在持续攀升,患者预后状况普遍不佳,5年生存率不足20%。
2024年5月,山东第一医科大学附属济宁第一人民医院和奥地利约翰开普勒大学的团队在Hepatology杂志在线发表了题为“Comprehensive profiling of lipid metabolic reprogramming expands precision medicine for hepatocellular carcinoma”的研究论文,该文通讯作者为蒋树龙教授、马长林教授和虞甬教授,第一作者为刘庆斌博士、张祥宇博士与Jingjing Qi博士。该研究系统揭示了HCC中甘油三酯(TG)、磷脂酰胆碱(PC)和鞘脂(SL)的代谢重编程特征,并提出靶向饱和脂肪酸磷脂酰胆碱(SFA-PC)和长链鞘脂生物合成途径的治疗新策略。研究特别指出,通过抑制溶血磷脂酰胆碱酰基转移酶1(LPCAT1)和神经酰胺合酶5(CERS5),可能为HCC的精准治疗提供新的方向。中科新生命为该研究提供了H650医学高通量靶向代谢组和非靶脂质组检测服务。
肝细胞癌(HCC)是全球范围内引发癌症相关死亡的第二大主要病因,其具有高度异质性,这一特性致使临床上缺乏有效的治疗手段。现阶段,肝细胞癌的治疗选择极为有限。不仅如此,其在全球范围内的发病率还在持续攀升,患者预后状况普遍不佳,5年生存率不足20%。
2024年5月,山东第一医科大学附属济宁第一人民医院和奥地利约翰开普勒大学的团队在Hepatology杂志在线发表了题为“Comprehensive profiling of lipid metabolic reprogramming expands precision medicine for hepatocellular carcinoma”的研究论文,该文通讯作者为蒋树龙教授、马长林教授和虞甬教授,第一作者为刘庆斌博士、张祥宇博士与Jingjing Qi博士。该研究系统揭示了HCC中甘油三酯(TG)、磷脂酰胆碱(PC)和鞘脂(SL)的代谢重编程特征,并提出靶向饱和脂肪酸磷脂酰胆碱(SFA-PC)和长链鞘脂生物合成途径的治疗新策略。研究特别指出,通过抑制溶血磷脂酰胆碱酰基转移酶1(LPCAT1)和神经酰胺合酶5(CERS5),可能为HCC的精准治疗提供新的方向。中科新生命为该研究提供了H650医学高通量靶向代谢组和非靶脂质组检测服务。

研究材料
人癌和癌旁组织各种细胞系(Huh7、HepG2、Hep3B、PLC/PRF5和HepaRG)
模型小鼠
技术路线
步骤1:样本分析——收集48对HCC肿瘤及正常组织,通过转录组、高通量靶向代谢组学和脂质组学分析代谢变化。
步骤2:标志物筛选——利用随机森林算法筛选脂质代谢相关基因作为HCC标志物。
步骤3:LPCAT1验证——敲低LPCAT1,检测细胞凋亡、DNA复制及膜流动性,并通过裸鼠实验观察肿瘤生长。
步骤4:CERS5验证——敲低CERS5,检测细胞活力及自噬体-脂滴共定位,分析异种移植瘤脂质组,观察裸鼠肿瘤生长。
步骤5:FTY720实验——用FTY720(一种鞘氨醇-1-磷酸类似物)处理HCC细胞,评估其对增殖和肿瘤生长的影响。
研究结果
1. HCC代谢组、脂质组和转录组分析概述
对48对肝癌及癌旁样本进行多组学分析:H650靶向代谢组:对353种极性代谢物绝对定量;非靶脂质组:对3508种脂质相对定量;转录组:鉴定19102个基因,其中5268个基因显著差异表达。
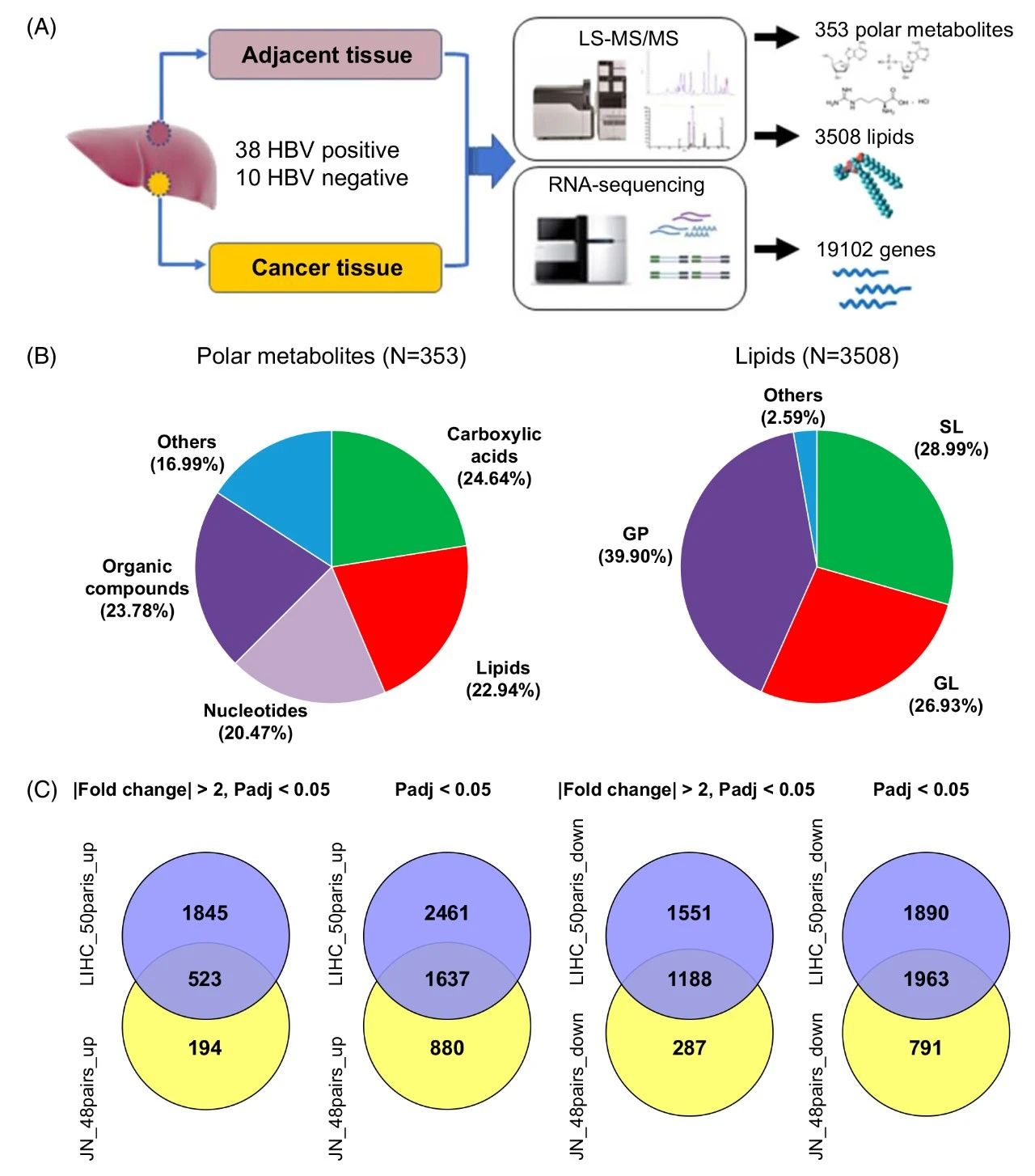 图1 HCC多组学分析概述
2. 转录组-代谢组分析揭示了HCC组织的异常代谢特征
转录组分析:上调的差异表达基因(DEGs)富集于细胞周期、DNA复制及细胞外基质受体相互作用等通路。慢性乙型肝炎(HBV)阳性样本中,上调基因与microRNA和衰老途径相关;HBV阴性样本中,上调基因与孕激素介导的卵母细胞成熟途径相关。下调的DEGs主要涉及碳代谢、脂肪酸代谢和药物代谢等过程(图2A)。
H650医学高通量靶向代谢组鉴定出353种极性代谢物,其中62种显著差异,主要富集于ABC转运蛋白、中心碳代谢、胰高血糖素信号通路、胰岛素信号通路及甘油磷酸脂质代谢等通路(图2B)。非靶脂质组发现亚油酸、琥珀酸、鞘磷脂(SM)、磷酸胆碱和乙酰肉碱等脂质代谢异常。
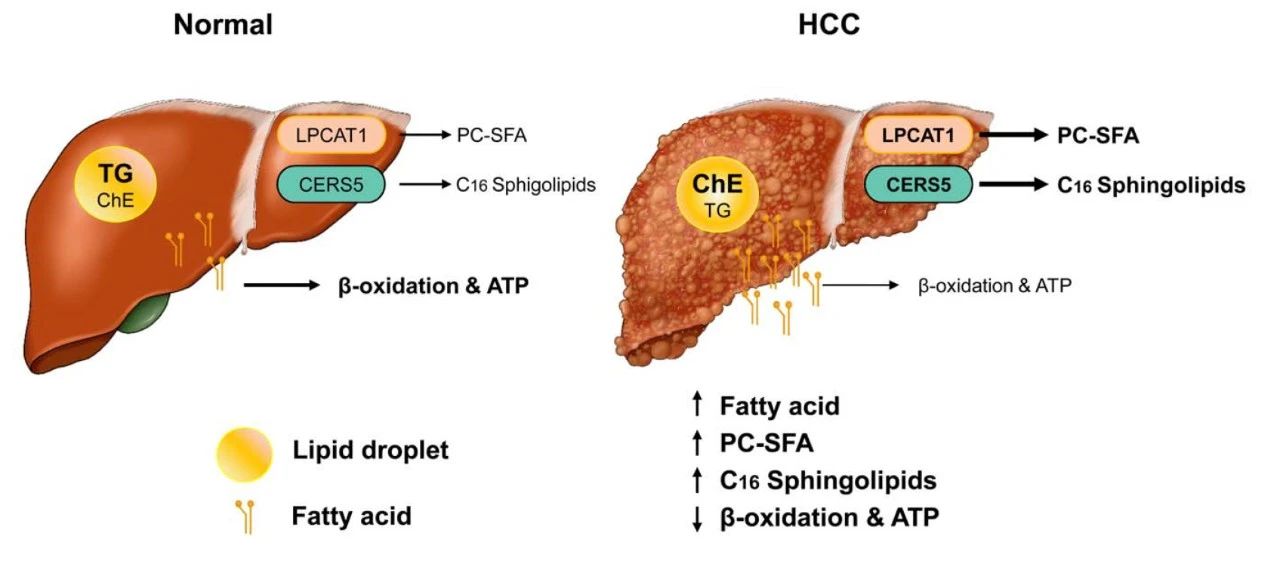
HCC样本中,糖酵解和戊糖磷酸途径关键酶表达增加,而葡萄糖新生相关基因下调;替代ω-氧化途径基因表达下调,从头脂肪生成基因上调;胆固醇和类固醇生成相关基因上调,CERS5和LPCAT1-4在HCC中显著高表达(图2C)。
综上所述,HCC中存在显著的代谢重编程,包括糖代谢、脂质氧化与降解及从头脂肪生成异常。磷脂酰胆碱(PC)和鞘脂(SL)的代谢紊乱可能由相关基因异常表达驱动(图2D)。
图1 HCC多组学分析概述
2. 转录组-代谢组分析揭示了HCC组织的异常代谢特征
转录组分析:上调的差异表达基因(DEGs)富集于细胞周期、DNA复制及细胞外基质受体相互作用等通路。慢性乙型肝炎(HBV)阳性样本中,上调基因与microRNA和衰老途径相关;HBV阴性样本中,上调基因与孕激素介导的卵母细胞成熟途径相关。下调的DEGs主要涉及碳代谢、脂肪酸代谢和药物代谢等过程(图2A)。
H650医学高通量靶向代谢组鉴定出353种极性代谢物,其中62种显著差异,主要富集于ABC转运蛋白、中心碳代谢、胰高血糖素信号通路、胰岛素信号通路及甘油磷酸脂质代谢等通路(图2B)。非靶脂质组发现亚油酸、琥珀酸、鞘磷脂(SM)、磷酸胆碱和乙酰肉碱等脂质代谢异常。
HCC样本中,糖酵解和戊糖磷酸途径关键酶表达增加,而葡萄糖新生相关基因下调;替代ω-氧化途径基因表达下调,从头脂肪生成基因上调;胆固醇和类固醇生成相关基因上调,CERS5和LPCAT1-4在HCC中显著高表达(图2C)。
综上所述,HCC中存在显著的代谢重编程,包括糖代谢、脂质氧化与降解及从头脂肪生成异常。磷脂酰胆碱(PC)和鞘脂(SL)的代谢紊乱可能由相关基因异常表达驱动(图2D)。
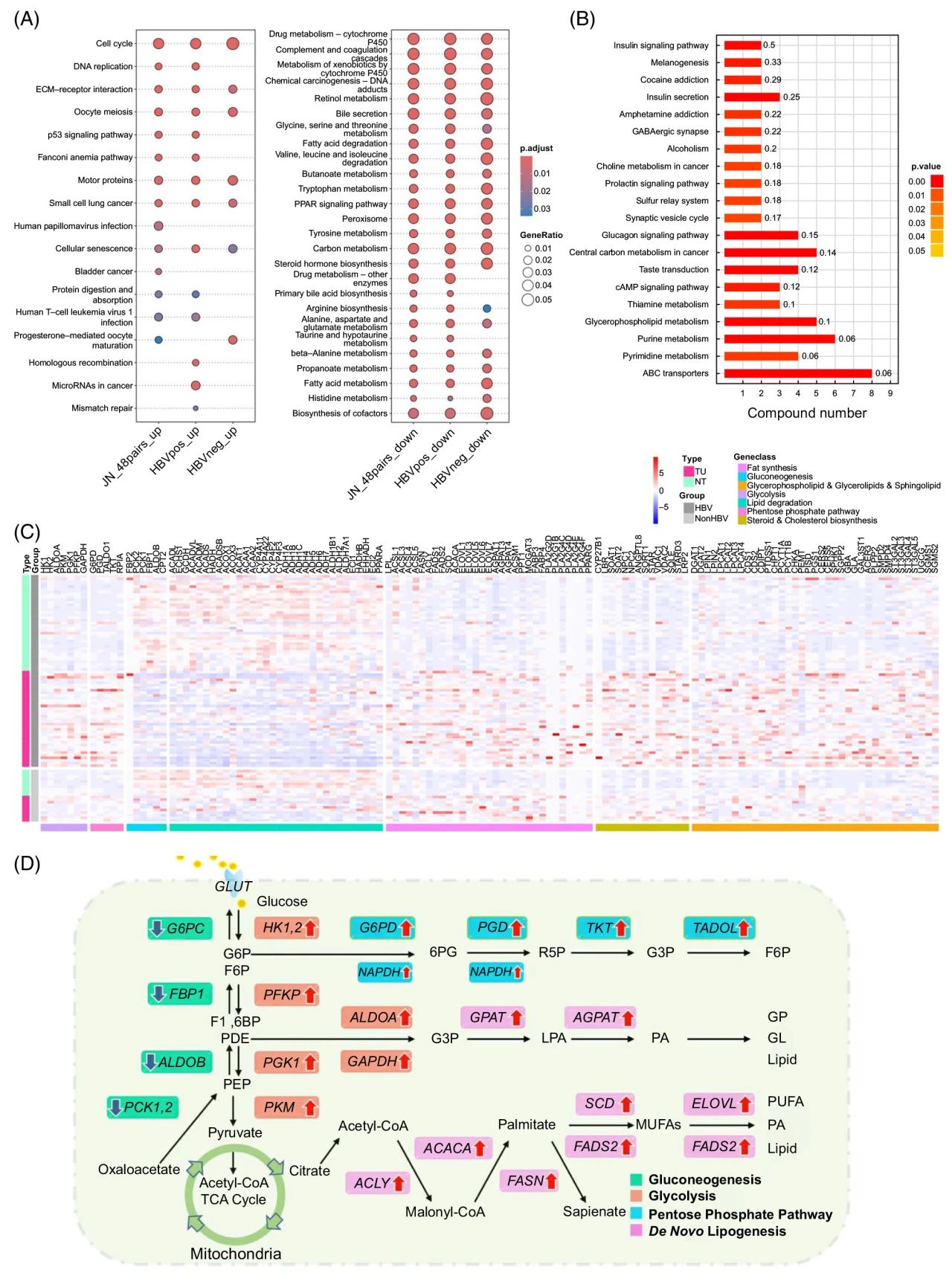 图2 转录组和代谢组分析显示了HCC代谢重编程的特征
3. HCC潜在诊断/预后生物标志物
通过机器学习策略,结合脂质组、转录组数据及TCGA数据库分析,鉴定出两个关键肿瘤驱动基因:CERS5和LPCAT1。二者通过重塑含饱和脂肪酸的磷脂酰胆碱(SFA-PC)和含C16的长链鞘脂类生物合成途径,驱动HCC进展,可作为潜在的诊断和预后生物标志物。
图2 转录组和代谢组分析显示了HCC代谢重编程的特征
3. HCC潜在诊断/预后生物标志物
通过机器学习策略,结合脂质组、转录组数据及TCGA数据库分析,鉴定出两个关键肿瘤驱动基因:CERS5和LPCAT1。二者通过重塑含饱和脂肪酸的磷脂酰胆碱(SFA-PC)和含C16的长链鞘脂类生物合成途径,驱动HCC进展,可作为潜在的诊断和预后生物标志物。
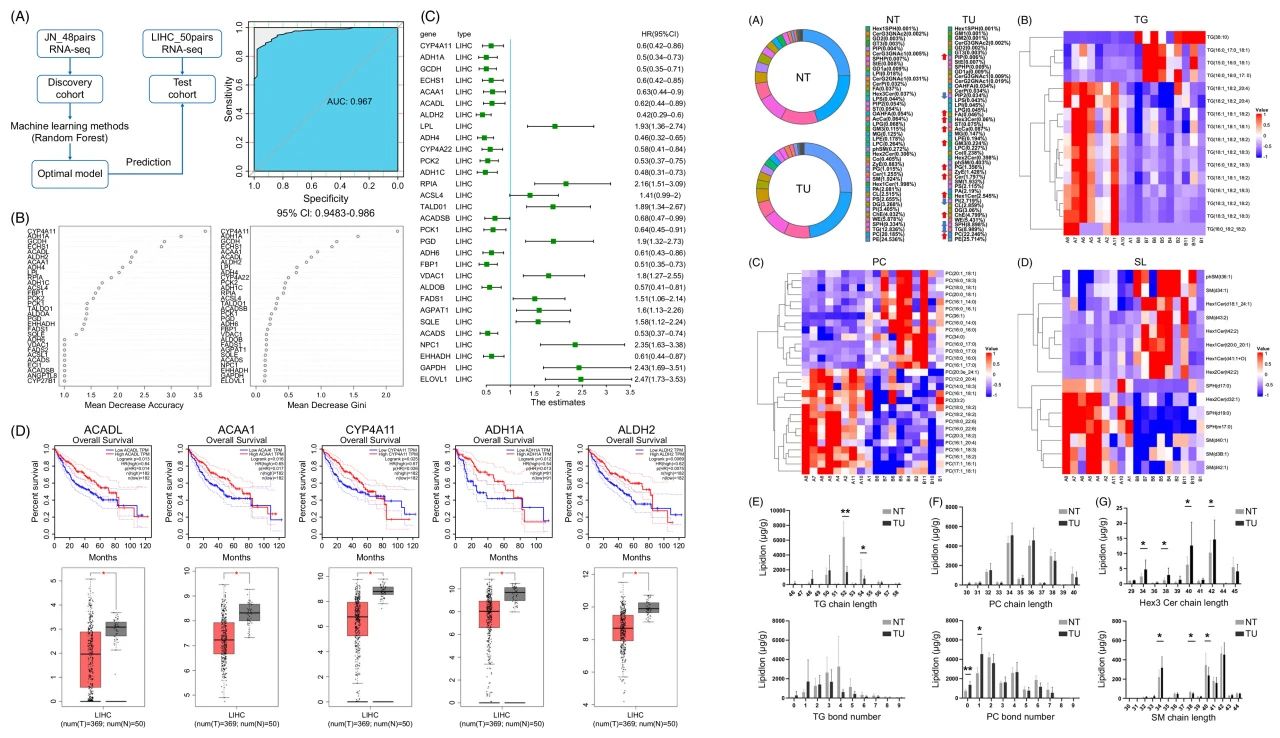 图3 确定HCC的诊断/预后生物标志物
4. LPCAT1和CERS5作为HCC潜在治疗靶点的验证
LPCAT1在HCC中的作用:LPCAT1在HCC肿瘤组织中显著高表达,且其高表达与患者的不良预后密切相关。抑制LPCAT1可显著增加HCC细胞的凋亡率,并引起细胞周期停滞。并且在裸鼠模型中,LPCAT1的抑制有效抑制了肿瘤生长,进一步证实了其作为治疗靶点的潜力。
CERS5在HCC中的作用:CERS5在HCC中同样呈现高表达,且与患者的不良预后相关。抑制CERS5导致HCC细胞中脂滴积累和甘油三酯(TG)含量显著增加。在裸鼠模型中,CERS5的抑制同样表现出显著的肿瘤生长抑制作用。此外,CERS5的抑制还影响了脂质代谢,导致长链鞘脂的减少和TG的积累,提示其在脂质代谢调控中的重要作用。
综上所述,LPCAT1和CERS5在HCC中均表现出显著的促癌作用,且其抑制在体外和体内实验中均显示出良好的抗肿瘤效果,表明它们是有潜力的HCC治疗靶点。
图3 确定HCC的诊断/预后生物标志物
4. LPCAT1和CERS5作为HCC潜在治疗靶点的验证
LPCAT1在HCC中的作用:LPCAT1在HCC肿瘤组织中显著高表达,且其高表达与患者的不良预后密切相关。抑制LPCAT1可显著增加HCC细胞的凋亡率,并引起细胞周期停滞。并且在裸鼠模型中,LPCAT1的抑制有效抑制了肿瘤生长,进一步证实了其作为治疗靶点的潜力。
CERS5在HCC中的作用:CERS5在HCC中同样呈现高表达,且与患者的不良预后相关。抑制CERS5导致HCC细胞中脂滴积累和甘油三酯(TG)含量显著增加。在裸鼠模型中,CERS5的抑制同样表现出显著的肿瘤生长抑制作用。此外,CERS5的抑制还影响了脂质代谢,导致长链鞘脂的减少和TG的积累,提示其在脂质代谢调控中的重要作用。
综上所述,LPCAT1和CERS5在HCC中均表现出显著的促癌作用,且其抑制在体外和体内实验中均显示出良好的抗肿瘤效果,表明它们是有潜力的HCC治疗靶点。
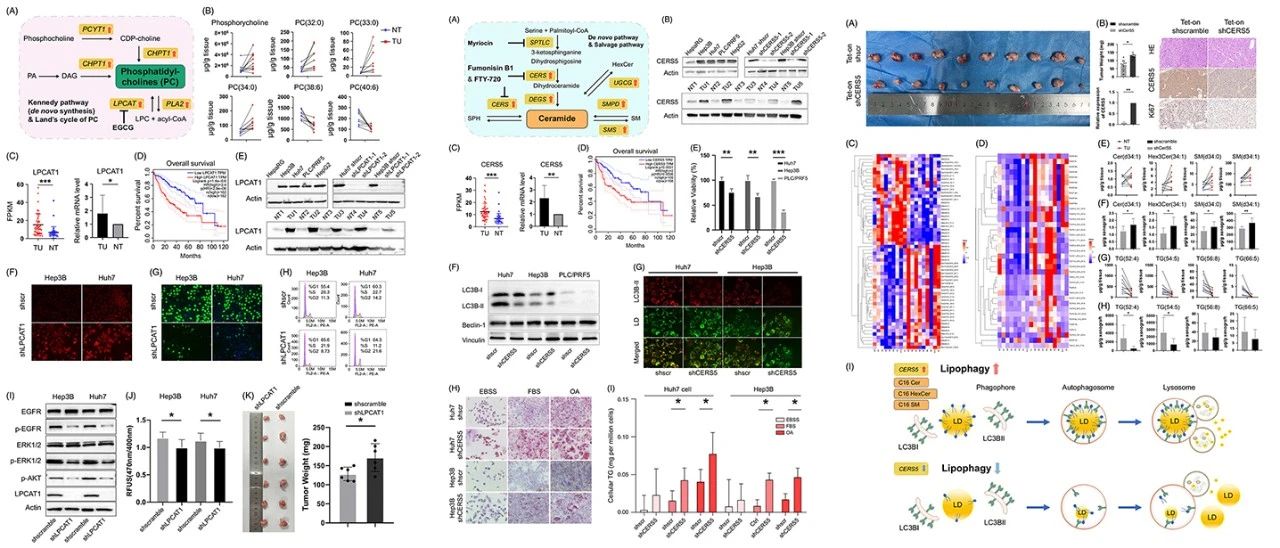 图4 LPCAT1(左图)和CERS5(中-右图)对HCC的生长影响
图4 LPCAT1(左图)和CERS5(中-右图)对HCC的生长影响
总结
这项研究通过系统分析肝细胞癌(HCC)中的代谢重编程,深入揭示了脂质代谢在HCC发生发展中的关键作用,并鉴定出一系列潜在的诊断标志物和治疗靶点。这些研究成果为HCC的精准医疗提供了重要的理论依据和新视角,有望推动基于代谢调控的新型治疗策略的开发,从而改善HCC患者的临床预后。
中科可以提供的帮助 H800 医学高通量靶向代谢组:全覆盖H650 医学高通量靶向代谢组检测物质。能够实现对近 800 种物质进行靶向检测,在这些物质当中涵盖了 120 余种脂肪酸类物质。采用全标品开发模式,其优势显著,检测所得结果精准可靠,无需再另行验证。
中科优品推荐 【中科新生命】全新推出H800医学高通量靶向代谢组产品,精准定性,绝对定量及结果无需验证的特点,一次满足您的代谢组学研究需求,检测范围覆盖800种重要功能及代谢物,覆盖核心代谢通路。