上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Nat Hum Behav | 复旦大学郁金泰/程炜团队又有新突破!UKB队列外显子分析揭示神经质罕见基因突变
930 人阅读发布时间:2024-12-18 16:40
 神经质是一种可遗传的人格特征,基于谱系的研究估计神经质的遗传率约为48%,而全基因组关联研究(GWASs)检测到的常见单核苷酸多态性(snp)解释了约15%的表型变异。
2024年11月,复旦大学华山医院神经内科的郁金泰团队和复旦大学脑激发智能科学技术研究所程炜团队在Nature Human Behaviour上发表了题为“Large-scale exome sequencing identified 18 novel genes for neuroticism in 394,005 UK-based individuals”的研究文章,使用来自UK Biobank (UKB)完全发布的外显子组测序数据分析了蛋白质编码变异对神经质的影响。
神经质是一种可遗传的人格特征,基于谱系的研究估计神经质的遗传率约为48%,而全基因组关联研究(GWASs)检测到的常见单核苷酸多态性(snp)解释了约15%的表型变异。
2024年11月,复旦大学华山医院神经内科的郁金泰团队和复旦大学脑激发智能科学技术研究所程炜团队在Nature Human Behaviour上发表了题为“Large-scale exome sequencing identified 18 novel genes for neuroticism in 394,005 UK-based individuals”的研究文章,使用来自UK Biobank (UKB)完全发布的外显子组测序数据分析了蛋白质编码变异对神经质的影响。

研究材料
350,770例UK Biobank的外显子组数据
技术路线
步骤1:使用UKB的454,787个外显子组测序数据经过QC过滤得到350,770名无血缘关系样本,对其中的变异做注释,并获取12项神经质行为指标数据;
步骤2:根据pLI评分以及REVEL得分做变异筛选;
步骤3:分别对罕见和常见变异进行基因崩溃和单变异关联分析;
步骤4:通过lovo分析、条件分析、多维生物注释、与神经精神表型和神经影像学标志关联,来完善已确定关联的解释并验证合理性;
步骤5:利用BHR计算罕见编码变异的遗传力以及13种表型的遗传相关性;
步骤6:通过MR分析确定具有因果关系的基因座。
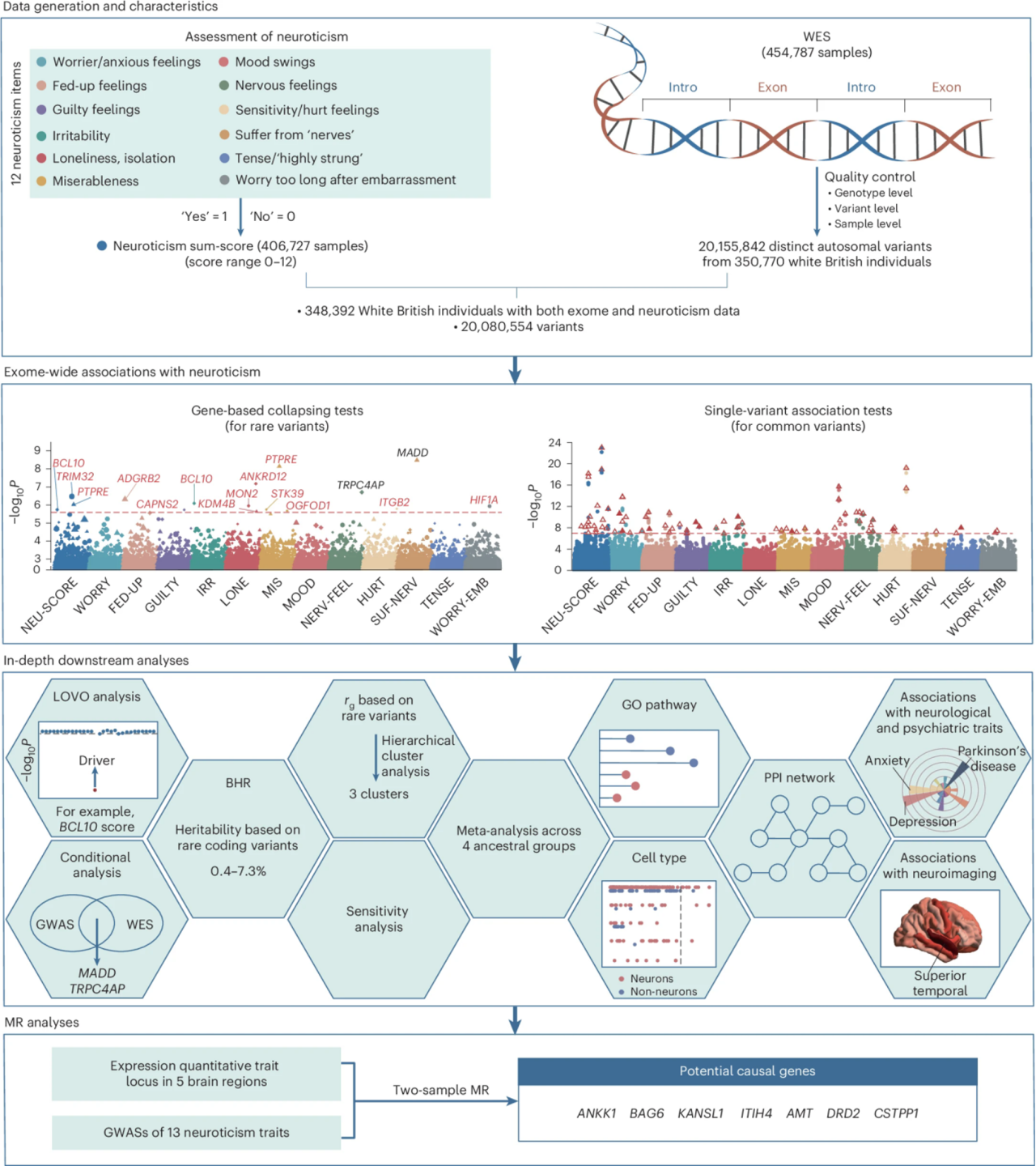 图1 数据分析流程
图1 数据分析流程
实验结果
1. 外显子组罕见变异分析
将2850个pLOF不耐受基因(pLI评分≥0.9)的罕见变异定义为5类,LOF变异体和错义变异体的负担(REVEL > 0.75)与较高的神经质综合评分显著相关。
为了确定神经质的潜在负责基因,使用SAIGE-GENE+进行了基于基因的崩溃测试,Bonferroni校正最大检测基因数共确定了涉及14个基因和基因性状对的43个显著关联。除GWAS中已报道的TRPC4AP和MADD外,其余12个基因(BCL10、TRIM32、PTPRE、ADGRB2、CAPNS2、MON2、ANKRD12、KDM4B、STK39、OGFOD1、ITGB2和HIF1A)均为首次发现与神经质相关。其中9对仅由pLOF变异驱动,2对仅由错义变异驱动,5对由pLOF和错义共同驱动,基因PTPRE和ITGB2显示出对神经质的保护作用。此外,在显著关联中,随着等位基因频率的降低,效应量增加。
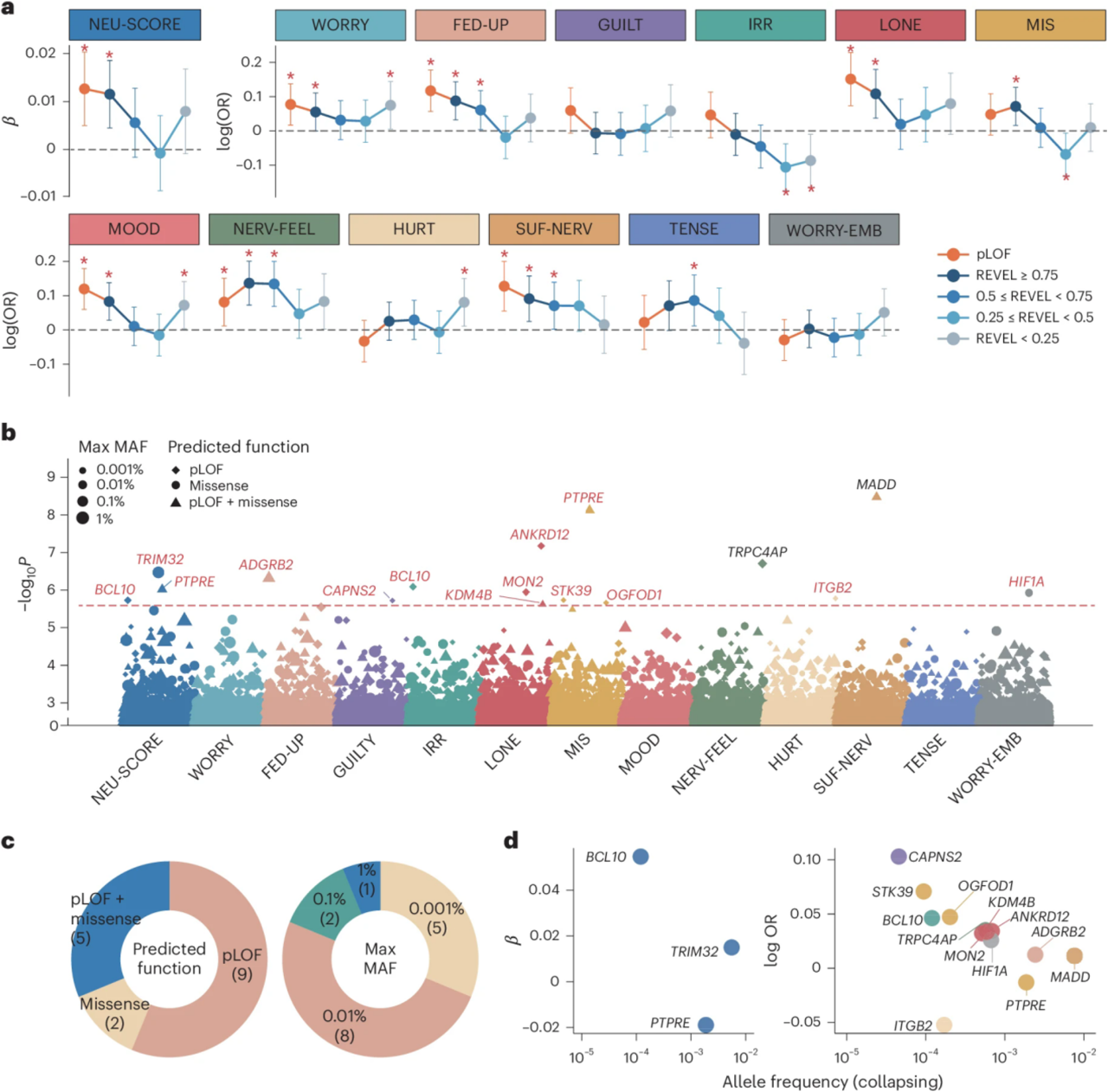 图2 外显子组罕见变异与神经质有关
2. 罕见变异和共同信号的趋同证据
利用UKB的全基因组输入基因型数据,在鉴定基因的上游和下游500千碱基(kb)范围内进行了局部GWAS,发现MADD和TRPC4AP分别与遭受紧张和紧张感觉有关。随后的条件分析发现,MADD罕见变异体对神经过敏的影响与附近的共同信号无关。
图2 外显子组罕见变异与神经质有关
2. 罕见变异和共同信号的趋同证据
利用UKB的全基因组输入基因型数据,在鉴定基因的上游和下游500千碱基(kb)范围内进行了局部GWAS,发现MADD和TRPC4AP分别与遭受紧张和紧张感觉有关。随后的条件分析发现,MADD罕见变异体对神经过敏的影响与附近的共同信号无关。
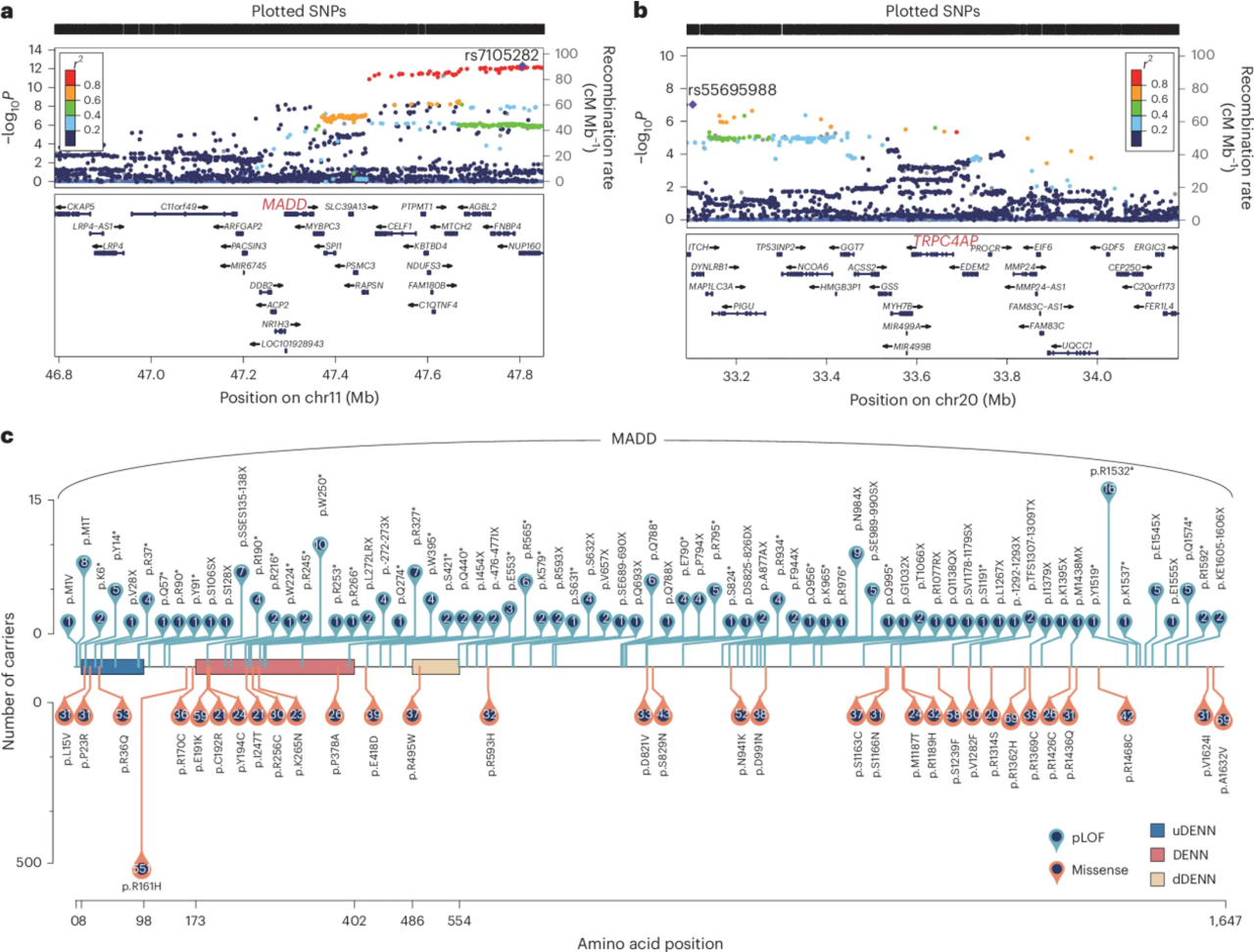 图3 神经症罕见变异与GWAS信号的收敛性
3. 单变关联检验显示43个变异
从外显子组数据中获得的常见变异,使用PLINK v2.0进行单变关联检验,共鉴定出43个snp,其中,10个关联信号与已报道的变异不存在连锁不平衡。在将43个snp定位到42个基因时,20个基因(BAG6、MTMR9、RP1L1、TNKS、MFHAS1、EP300、AMT、STAG1、ARHGAP27、H1-5、ZSCAN12、TRIM38、YLPM1、NPTX1、GGT7、PRRC2A、TAOK2、KANSL1、PPWD1和PPP6C)首次显示与神经质项目相关,且三分之一(13/43)的snp表现出多效性,并且每个变异的影响方向在多个神经质特征中是一致的。
图3 神经症罕见变异与GWAS信号的收敛性
3. 单变关联检验显示43个变异
从外显子组数据中获得的常见变异,使用PLINK v2.0进行单变关联检验,共鉴定出43个snp,其中,10个关联信号与已报道的变异不存在连锁不平衡。在将43个snp定位到42个基因时,20个基因(BAG6、MTMR9、RP1L1、TNKS、MFHAS1、EP300、AMT、STAG1、ARHGAP27、H1-5、ZSCAN12、TRIM38、YLPM1、NPTX1、GGT7、PRRC2A、TAOK2、KANSL1、PPWD1和PPP6C)首次显示与神经质项目相关,且三分之一(13/43)的snp表现出多效性,并且每个变异的影响方向在多个神经质特征中是一致的。
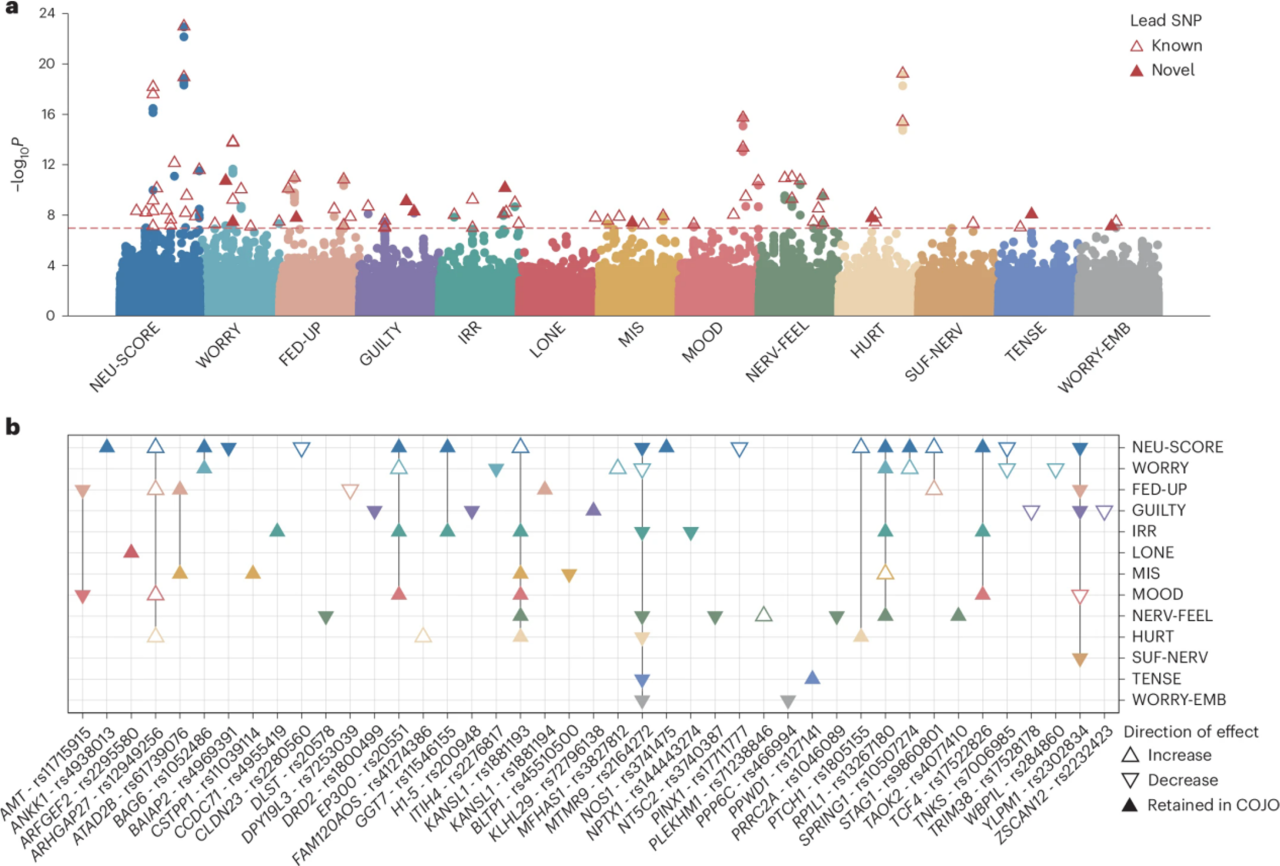 图4 外显子组范围内的单一常见变异与神经质有关
4. 神经过敏相关基因的生物学研究
为了了解神经症相关基因是如何参与生理和病理过程的,进行了一系列生物学分析。通路富集的56个基因涉及14显著。使用SynGO22查询这些基因在突触中的作用:共有8个基因参与突触定位(NPTX1、DRD2、BAIAP2、ARFGEF2、TAOK2和NOS1)和功能(MADD、BAIAP2、NOS1、DRD2、NPTX1、TAOK2和BLTP1)。在组织特异性水平上,发现在11种脑组织类型和11种非脑组织类型中显著富集。
在脑内56个基因的时间表达富集中,2岁时P值超过显著阈值。当只包括基于罕见变异的基因时,这一结果仍然显著,为了确定罕见变异基因在发育阶段的表达差异,在每次剔除一个相关基因后重新运行该分析,进行了敏感性分析,结果在2岁时始终显著。这些证据表明,遗传因素可能在很大程度上促进了儿童早期神经质和相关精神症状的发展。
为了探索哪些细胞类型可能与神经质有关,使用小鼠单细胞图谱的神经系统中的265种细胞类型进行了单侧Wilcoxon测试。有18个集群达到显著水平,其中以中脑抑制性神经元最为突出。
图4 外显子组范围内的单一常见变异与神经质有关
4. 神经过敏相关基因的生物学研究
为了了解神经症相关基因是如何参与生理和病理过程的,进行了一系列生物学分析。通路富集的56个基因涉及14显著。使用SynGO22查询这些基因在突触中的作用:共有8个基因参与突触定位(NPTX1、DRD2、BAIAP2、ARFGEF2、TAOK2和NOS1)和功能(MADD、BAIAP2、NOS1、DRD2、NPTX1、TAOK2和BLTP1)。在组织特异性水平上,发现在11种脑组织类型和11种非脑组织类型中显著富集。
在脑内56个基因的时间表达富集中,2岁时P值超过显著阈值。当只包括基于罕见变异的基因时,这一结果仍然显著,为了确定罕见变异基因在发育阶段的表达差异,在每次剔除一个相关基因后重新运行该分析,进行了敏感性分析,结果在2岁时始终显著。这些证据表明,遗传因素可能在很大程度上促进了儿童早期神经质和相关精神症状的发展。
为了探索哪些细胞类型可能与神经质有关,使用小鼠单细胞图谱的神经系统中的265种细胞类型进行了单侧Wilcoxon测试。有18个集群达到显著水平,其中以中脑抑制性神经元最为突出。
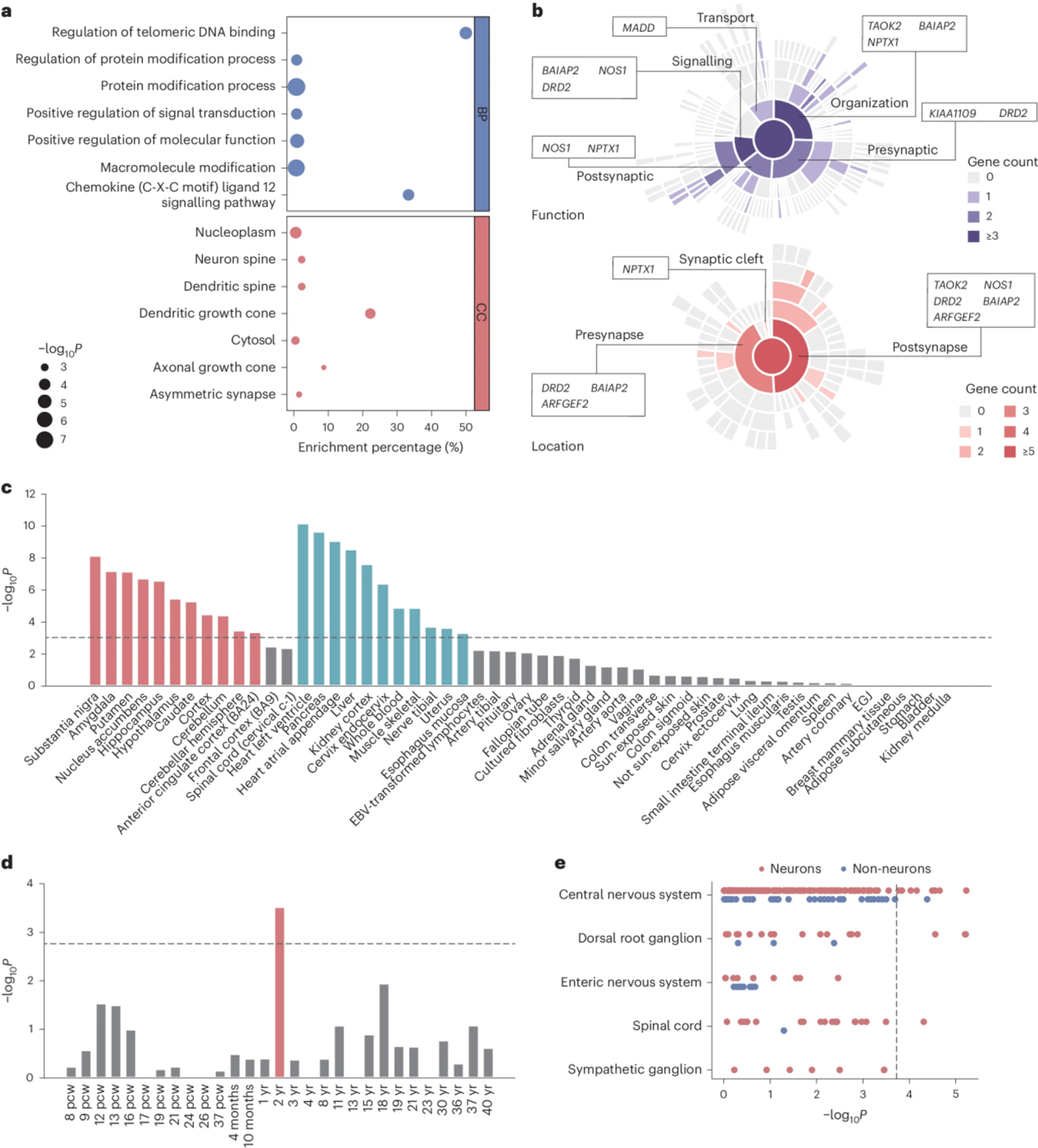 图5 56个神经症相关基因的生物学注释
5. 神经精神表型的多效性效应
测试神经症相关的编码变异与67种神经精神疾病和特征的相关性。发现176对显著,涉及12种神经疾病,10种精神疾病,8种认知能力和11种心理健康特征。与之前的研究结果一致,神经质与抑郁症状具有最强的遗传相关性,神经质相关变异与抑郁症状的关联最为明显。其他神经精神表型也存在潜在的多效性。
6. 神经质变异与神经影像学的关系
使用UKB的脑磁共振成像(MRI)数据进一步测试这些与神经质相关的变异是否也与大脑结构相关。共有1156个关联达到总体FDR Q < 0.05水平,其中最高的是右侧颞上表面积(n = 13)和左侧颞上体积(n = 13)。计算每个区域显著相关的绝对t值的平均值以评估神经症相关遗传因素对大脑解剖的总体影响。在左侧伏隔体积和右侧楔前叶区域观察到最明显的平均效应。
图5 56个神经症相关基因的生物学注释
5. 神经精神表型的多效性效应
测试神经症相关的编码变异与67种神经精神疾病和特征的相关性。发现176对显著,涉及12种神经疾病,10种精神疾病,8种认知能力和11种心理健康特征。与之前的研究结果一致,神经质与抑郁症状具有最强的遗传相关性,神经质相关变异与抑郁症状的关联最为明显。其他神经精神表型也存在潜在的多效性。
6. 神经质变异与神经影像学的关系
使用UKB的脑磁共振成像(MRI)数据进一步测试这些与神经质相关的变异是否也与大脑结构相关。共有1156个关联达到总体FDR Q < 0.05水平,其中最高的是右侧颞上表面积(n = 13)和左侧颞上体积(n = 13)。计算每个区域显著相关的绝对t值的平均值以评估神经症相关遗传因素对大脑解剖的总体影响。在左侧伏隔体积和右侧楔前叶区域观察到最明显的平均效应。
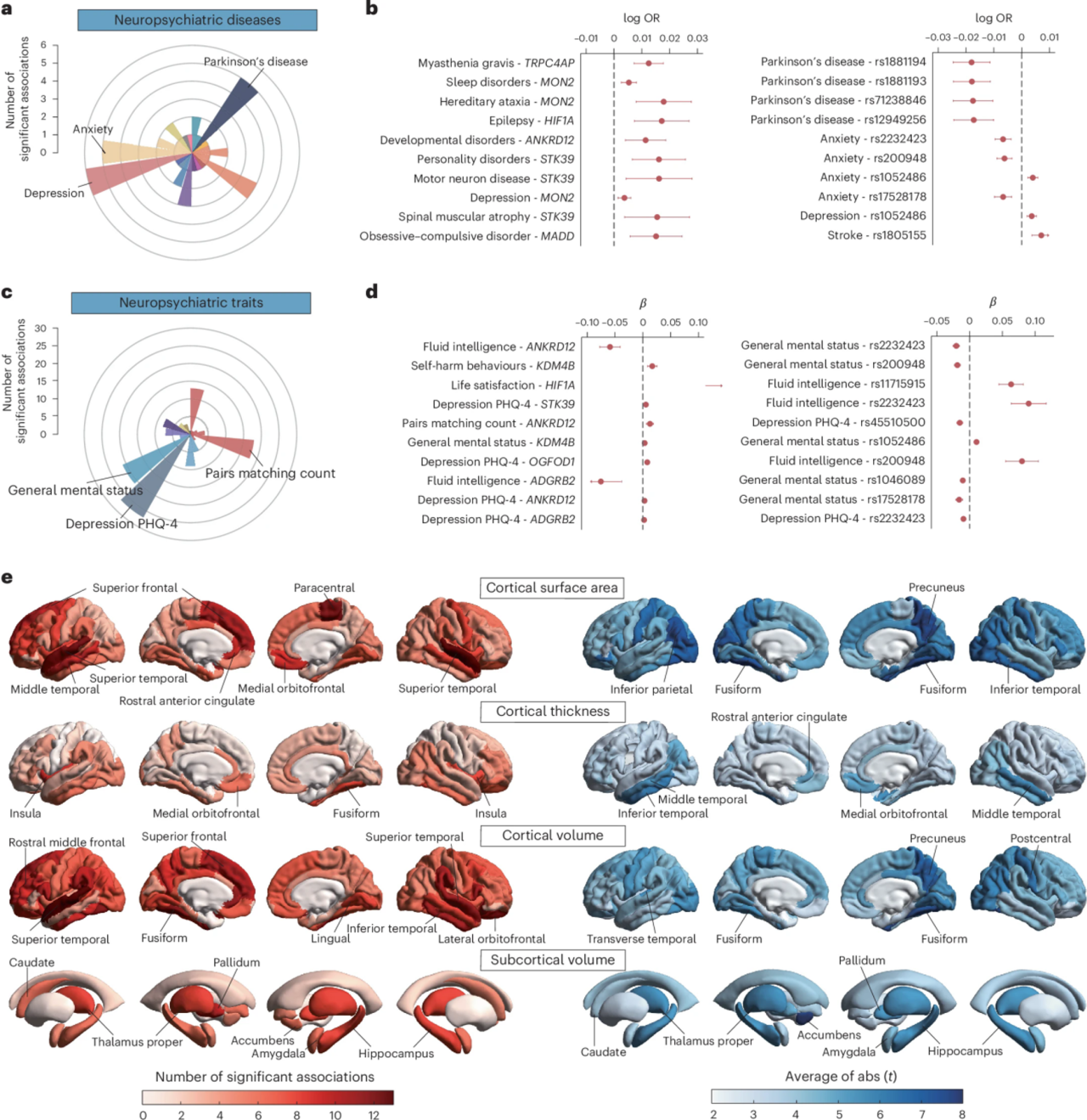 图6 与神经精神和神经影像学表型的关联
7. 神经质患者脑eQTL的MR分析
使用来自MetaBrain28和GWAS数据集的13种神经质特征16的五个大脑区域(皮层、基底神经节、海马、小脑和脊髓)的基因表达水平数据进行了MR分析。56个神经质相关基因中有23个获得了eqtl,对只有一个IV的基因采用Wald比值法,对有两个或两个以上IV的基因采用反方差加权(IVW)法作为两样本mr的主要分析方法。经Bonferroni校正,确定了26个与神经质相关的显著基因,涉及7个基因(ANKK1, BAG6, KANSL1, ITIH4, AMT, DRD2和CSTPP1)。对于MR发现的与神经质有因果关系的7个基因,通过Finan’s criteria、drugbank和Therapeutic Target database进一步审查了它们的可药物性。3个基因与可药物基因组重叠,4个基因(ANKK1、ITIH4、AMT和DRD2)被建立为药物靶点。
图6 与神经精神和神经影像学表型的关联
7. 神经质患者脑eQTL的MR分析
使用来自MetaBrain28和GWAS数据集的13种神经质特征16的五个大脑区域(皮层、基底神经节、海马、小脑和脊髓)的基因表达水平数据进行了MR分析。56个神经质相关基因中有23个获得了eqtl,对只有一个IV的基因采用Wald比值法,对有两个或两个以上IV的基因采用反方差加权(IVW)法作为两样本mr的主要分析方法。经Bonferroni校正,确定了26个与神经质相关的显著基因,涉及7个基因(ANKK1, BAG6, KANSL1, ITIH4, AMT, DRD2和CSTPP1)。对于MR发现的与神经质有因果关系的7个基因,通过Finan’s criteria、drugbank和Therapeutic Target database进一步审查了它们的可药物性。3个基因与可药物基因组重叠,4个基因(ANKK1、ITIH4、AMT和DRD2)被建立为药物靶点。
总结
文章共揭示了56个与神经质相关的基因,突出了与先前确定的GWAS结论的趋同,并引入了18个新发现。这些神经症相关基因与各种神经精神表型存在丰富的关系,其中一些是可药物性的,这表明它们有可能作为神经精神疾病的治疗干预措施。
中科优品推荐 WES测序可以更针对外显子区域做高深度测序,通过WES研究肿瘤突变特征、新生抗原、遗传易感基因也备受欢迎,与WES相关联的转录组、表观组、蛋白组、时空组学的联合应用也成为发文的强势加分项。