上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
项目文章Adv Mater | 重医附二院联合国家纳米科学中心等团队开发靶向递送纳米平台增强PROTAC蛋白降解能力
556 人阅读发布时间:2024-12-04 13:57
 靶向蛋白水解嵌合体(Proteolysis-targeting chimeras, PROTACs)是一类为降解蛋白而设计的双功能分子,主要将靶蛋白(POI)配体与招募E3泛素连接酶的配体利用化学键连接,这种相互作用触发POI的泛素化,导致其随后被泛素-蛋白酶体系统(UPS)降解。蛋白质降解与能量代谢联系密切,如外部营养供应的减少会引发自噬的上调,自噬通过降解细胞内蛋白质和细胞器来维持营养循环和代谢稳态。FMD治疗是一种众所周知的代谢改变,而其对肿瘤细胞蛋白酶抑制及PROTACs蛋白降解能力的影响尚未得到深入研究。
11月3日,重庆医科大学附属第二医院冉海涛教授、中国医学科学院肿瘤医院冯和林教授联合国家纳米科学中心王海研究员在Advanced Materials期刊上发表题为“Augmenting Protein Degradation Capacity of PROTAC through Energy Metabolism Regulation and Targeted Drug Delivery”的研究文章。该研究基于FMD策略通过调控肿瘤细胞能量代谢,增强细胞内泛素化水平,从而显著提高PROTAC药物对靶蛋白的高效降解。此外,构建了靶向递送PROTACs药物的纳米平台,与FMD 治疗相结合,进一步增强PROTAC的治疗效果。中科新生命为其提供了泛素化蛋白质组技术服务。
靶向蛋白水解嵌合体(Proteolysis-targeting chimeras, PROTACs)是一类为降解蛋白而设计的双功能分子,主要将靶蛋白(POI)配体与招募E3泛素连接酶的配体利用化学键连接,这种相互作用触发POI的泛素化,导致其随后被泛素-蛋白酶体系统(UPS)降解。蛋白质降解与能量代谢联系密切,如外部营养供应的减少会引发自噬的上调,自噬通过降解细胞内蛋白质和细胞器来维持营养循环和代谢稳态。FMD治疗是一种众所周知的代谢改变,而其对肿瘤细胞蛋白酶抑制及PROTACs蛋白降解能力的影响尚未得到深入研究。
11月3日,重庆医科大学附属第二医院冉海涛教授、中国医学科学院肿瘤医院冯和林教授联合国家纳米科学中心王海研究员在Advanced Materials期刊上发表题为“Augmenting Protein Degradation Capacity of PROTAC through Energy Metabolism Regulation and Targeted Drug Delivery”的研究文章。该研究基于FMD策略通过调控肿瘤细胞能量代谢,增强细胞内泛素化水平,从而显著提高PROTAC药物对靶蛋白的高效降解。此外,构建了靶向递送PROTACs药物的纳米平台,与FMD 治疗相结合,进一步增强PROTAC的治疗效果。中科新生命为其提供了泛素化蛋白质组技术服务。

研究材料
143B、U2OS、MDA-MB-231、MCF-7和A549肿瘤细胞
研究步骤
步骤1:发现FMD治疗可提高泛素化、自噬和蛋白质代谢水平
步骤2:揭示FMD 治疗通过提高泛素化蛋白、增强蛋白酶体活性和刺激肿瘤细胞自噬来增强PROTAC的功效
步骤3:开发了靶向递送PROTACs的纳米载体
步骤4:研究了NP@M143和NP@M231体内肿瘤靶向能力
步骤5:表明靶向纳米药物系统与FMD治疗相结合,可以显着增强PROTAC的治疗效果
步骤6:证实nFAK@M231和nBRD@M231对MDA-MB-231肿瘤的体内抑制作用
研究结果
1. FMD治疗后肿瘤细胞的泛素化蛋白质组学分析
泛素化蛋白质组学分析结果显示,FDM处理的143B 和MDA-MB-231中泛素化肽段和蛋白的数量明显增加。对最具代表性的DEPs鉴定并分为三大类:UPS、自噬和去泛素化。并且与对照组(常规培养)相比,143B+F组和MDA-MB-231+F组泛素化系统和自噬类别中DEPs的表达水平升高,而去泛素化水平降低。GO和KEGG功能聚类显示,143B+F和MDA-MB-231+F组中表达增加的蛋白与泛素特异性蛋白降解和自噬调节密切相关。以上表明,FMD治疗可提高泛素化、自噬和蛋白质代谢水平。
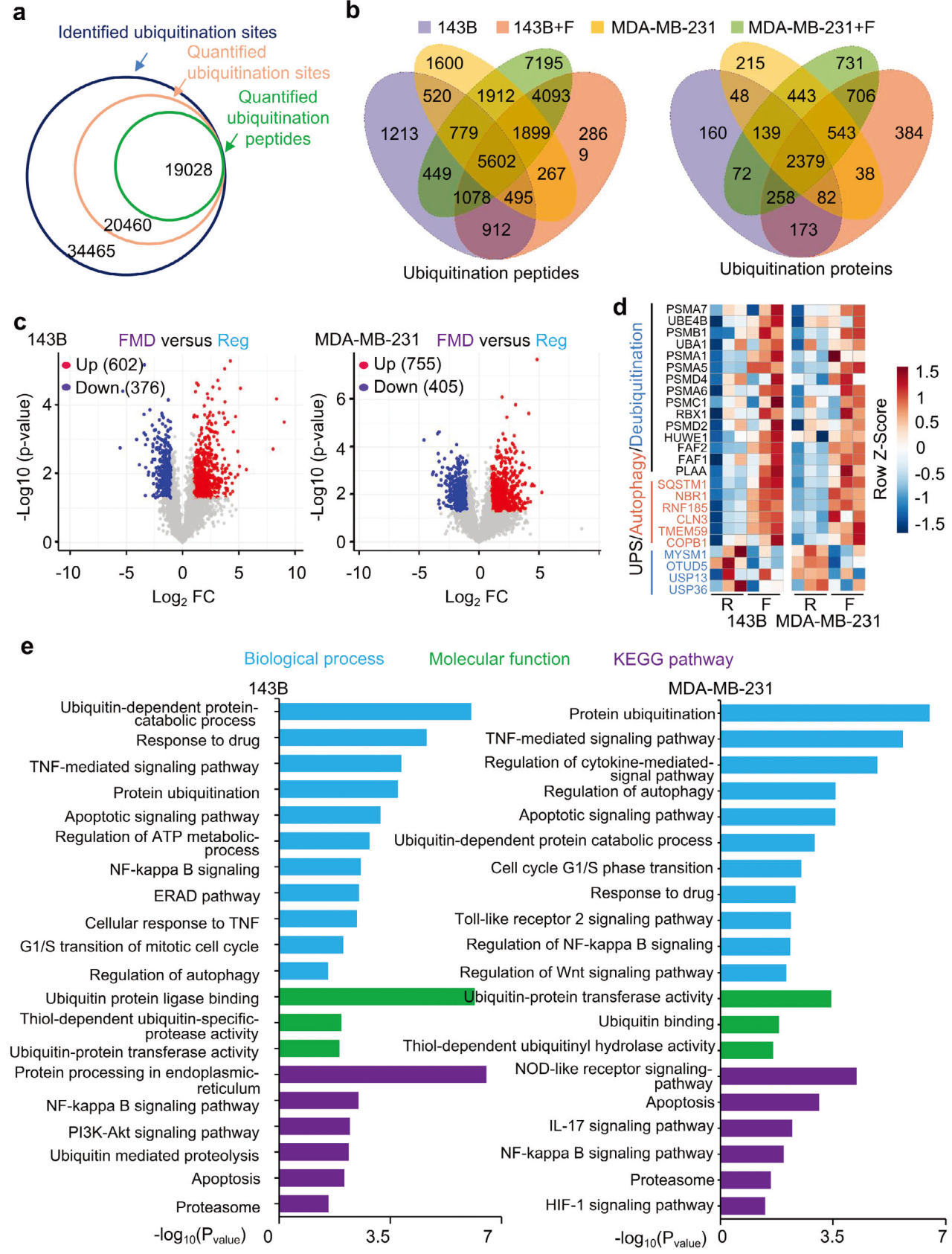 图1 FMD处理143B和MDA-MB-231肿瘤细胞泛素化蛋白组分析
2. FMD治疗增强PROTAC介导的蛋白质降解
基于抗体进一步验证泛素化蛋白的表达情况,Western blot显示和质谱结果一致性,即:FMD治疗肿瘤细胞中泛素化蛋白增加。通过商业20S蛋白酶体活性测定发现143B+F和MDA-MB-231+F组蛋白酶体活性显著增强。随后,采用FAK-P和BRD4-P作为模型药物,评估FMD治疗对PROTAC蛋白降解和抗肿瘤疗效的影响。FAK激活磷酸化AKT (pAKT)-mTOR信号通路以促进肿瘤细胞增殖和存活,而BRD家族蛋白则影响c-MYC表达和pAKT-mTOR通路。同样基于Western blot进行相关验证:与对照组相比,对于BRD4-P,143B+F和MDA-MB-231+F组中BRD2、BRD3和BRD4降解增加,FMD组下游pAKT和c-MYC的下调也更为明显。另外也发现自噬相关蛋白的增强以及抑制自噬的蛋白质下调。这些发现表明 FMD 治疗通过提高泛素化蛋白、增强蛋白酶体活性和刺激肿瘤细胞自噬来增强PROTAC的功效。
图1 FMD处理143B和MDA-MB-231肿瘤细胞泛素化蛋白组分析
2. FMD治疗增强PROTAC介导的蛋白质降解
基于抗体进一步验证泛素化蛋白的表达情况,Western blot显示和质谱结果一致性,即:FMD治疗肿瘤细胞中泛素化蛋白增加。通过商业20S蛋白酶体活性测定发现143B+F和MDA-MB-231+F组蛋白酶体活性显著增强。随后,采用FAK-P和BRD4-P作为模型药物,评估FMD治疗对PROTAC蛋白降解和抗肿瘤疗效的影响。FAK激活磷酸化AKT (pAKT)-mTOR信号通路以促进肿瘤细胞增殖和存活,而BRD家族蛋白则影响c-MYC表达和pAKT-mTOR通路。同样基于Western blot进行相关验证:与对照组相比,对于BRD4-P,143B+F和MDA-MB-231+F组中BRD2、BRD3和BRD4降解增加,FMD组下游pAKT和c-MYC的下调也更为明显。另外也发现自噬相关蛋白的增强以及抑制自噬的蛋白质下调。这些发现表明 FMD 治疗通过提高泛素化蛋白、增强蛋白酶体活性和刺激肿瘤细胞自噬来增强PROTAC的功效。
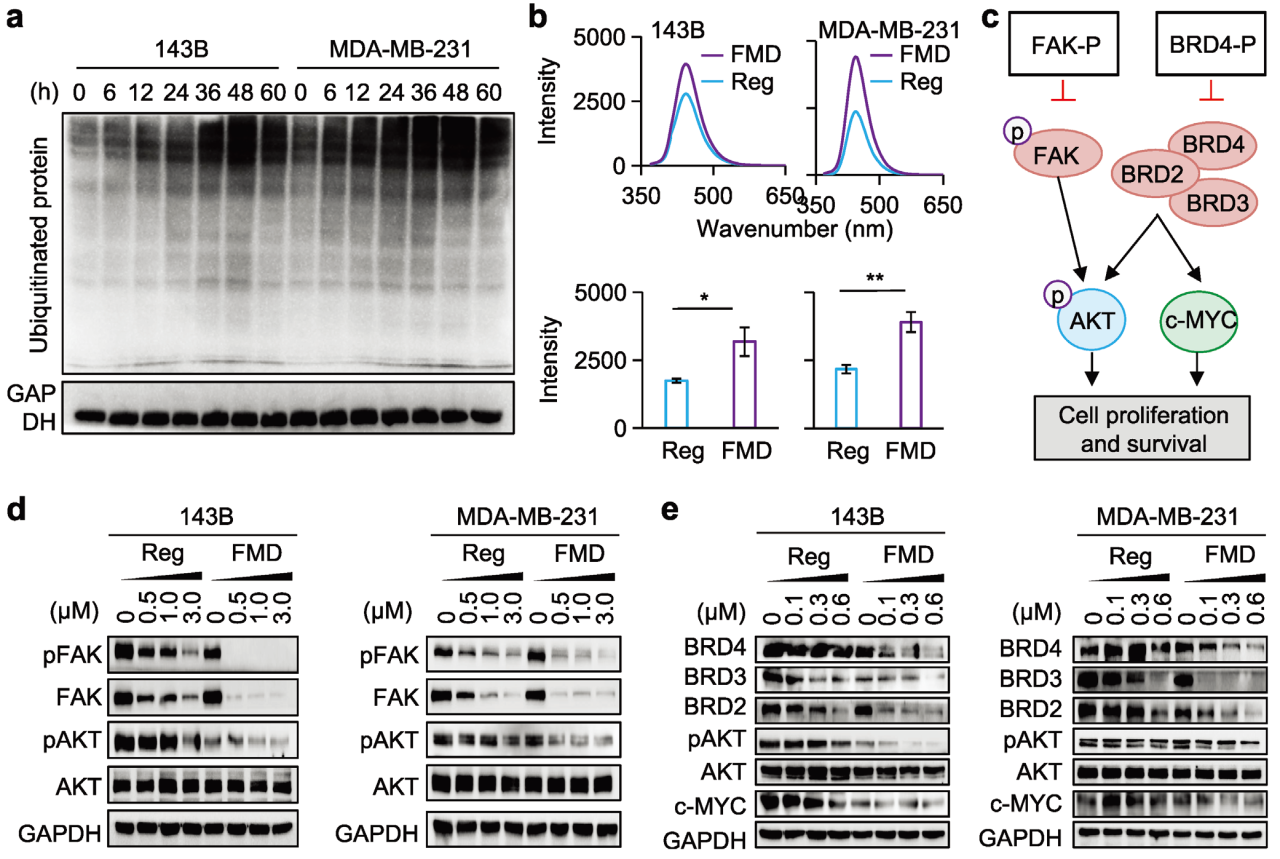 图2 FDA治疗增强protac介导的蛋白质降解
3. 靶向递送PROTACs的纳米载体研究
考虑到FAK-P或BRD4-P的肿瘤聚集性差和不溶性,研究者合成了二氧化硅包覆的氧化铁纳米颗粒(Si-Fe),并提取143B或MDA-MB-231细胞膜涂在Si-Fe上,形成NP@M143或NP@M231来实现肿瘤靶向递送。通过共聚焦成像和流式细胞术发现FMD处理增加了143B和MDA-MB-231细胞中NP@M143和NP@M231细胞摄取。作者研究了纳米颗粒的细胞毒性,当与FMD联合治疗时,nFAK@M143或nBRD@M143以浓度依赖的方式抑制143B肿瘤细胞的增殖。
图2 FDA治疗增强protac介导的蛋白质降解
3. 靶向递送PROTACs的纳米载体研究
考虑到FAK-P或BRD4-P的肿瘤聚集性差和不溶性,研究者合成了二氧化硅包覆的氧化铁纳米颗粒(Si-Fe),并提取143B或MDA-MB-231细胞膜涂在Si-Fe上,形成NP@M143或NP@M231来实现肿瘤靶向递送。通过共聚焦成像和流式细胞术发现FMD处理增加了143B和MDA-MB-231细胞中NP@M143和NP@M231细胞摄取。作者研究了纳米颗粒的细胞毒性,当与FMD联合治疗时,nFAK@M143或nBRD@M143以浓度依赖的方式抑制143B肿瘤细胞的增殖。
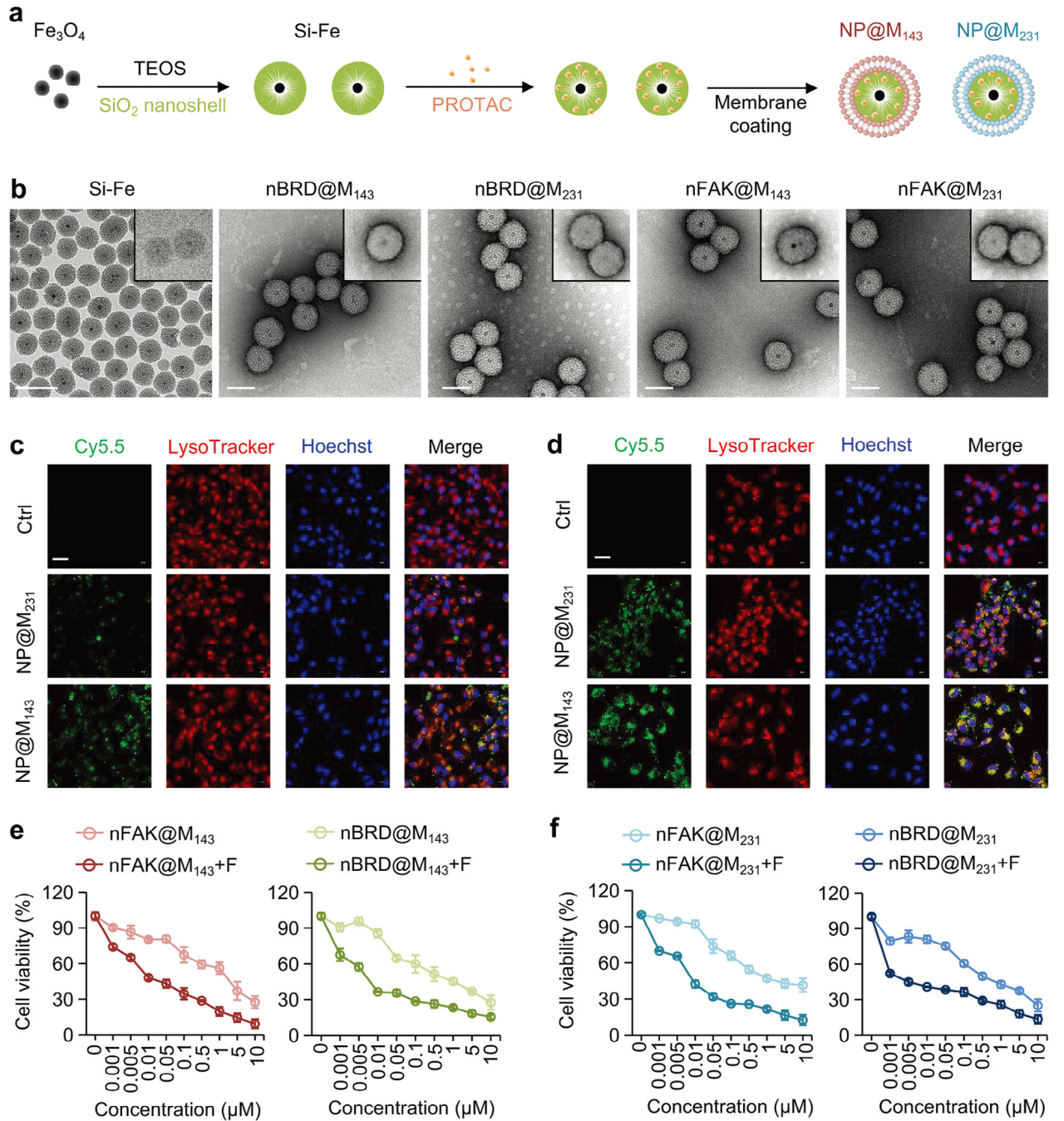 图3 靶向递送PROTACs的纳米载体的研制
4. NP@M143和NP@M231体内肿瘤靶向能力
基于荧光成像及磁共振成像等评估了肿瘤靶向递送能力,结果表明该纳米载体可以在FMD处理的143B或MDA-MB-231肿瘤中有效提高PROTACs的递送效率。
图3 靶向递送PROTACs的纳米载体的研制
4. NP@M143和NP@M231体内肿瘤靶向能力
基于荧光成像及磁共振成像等评估了肿瘤靶向递送能力,结果表明该纳米载体可以在FMD处理的143B或MDA-MB-231肿瘤中有效提高PROTACs的递送效率。
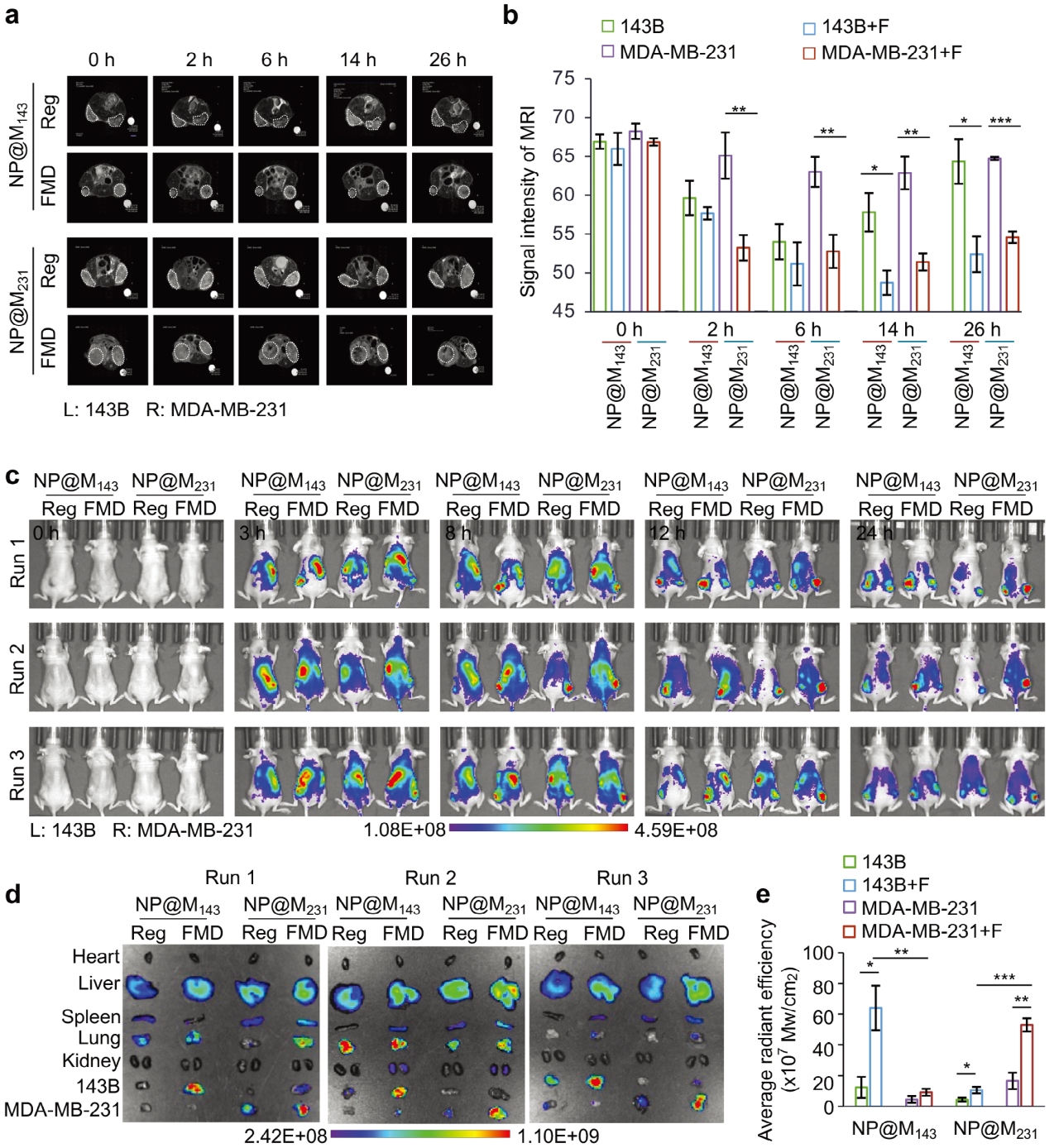 图4 NP@M143和NP@M231体内肿瘤靶向能力
5. 负载PROTAC纳米药物系统的体内抗肿瘤效果
在确认靶向药物递送后,用nFAK@M143、nFAK@M231、nBRD@M143或nBRD@M231治疗143B和MDA-MB-231肿瘤小鼠。结果显示,nFAK@M143和nFAK@M231都具有抗143B肿瘤功效,且 FMD治疗增强nFAK@M143、nFAK@M231、nBRD@M143或nBRD@M231对143B 肿瘤增殖的抑制作用。以上结果并通过肿瘤图像和权重进一步得到验证。这些结果表明靶向纳米药物系统与 FMD 治疗相结合,可以显著增强PROTAC的治疗效果。
图4 NP@M143和NP@M231体内肿瘤靶向能力
5. 负载PROTAC纳米药物系统的体内抗肿瘤效果
在确认靶向药物递送后,用nFAK@M143、nFAK@M231、nBRD@M143或nBRD@M231治疗143B和MDA-MB-231肿瘤小鼠。结果显示,nFAK@M143和nFAK@M231都具有抗143B肿瘤功效,且 FMD治疗增强nFAK@M143、nFAK@M231、nBRD@M143或nBRD@M231对143B 肿瘤增殖的抑制作用。以上结果并通过肿瘤图像和权重进一步得到验证。这些结果表明靶向纳米药物系统与 FMD 治疗相结合,可以显著增强PROTAC的治疗效果。
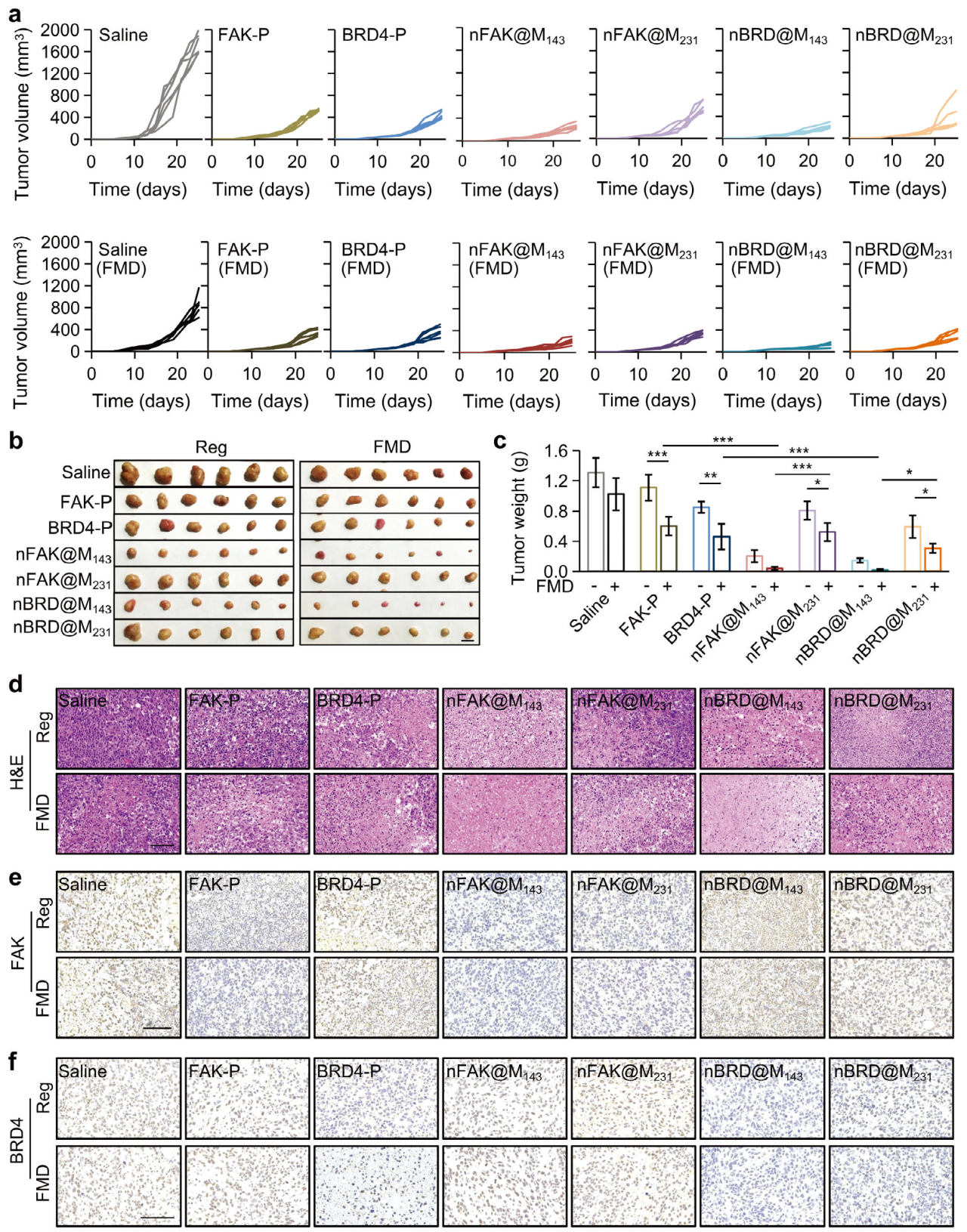 图5 负载PROTAC纳米药物的体内抗肿瘤效果
6. nFAK@M231和nBRD@M231对MDA-MB-231肿瘤的体内抑制作用
最后,研究了不同治疗方法对MDA-MB-231肿瘤的抑制作用。结果显示nFAK@M231或nBRD@M231结合FMD是最有效的抗肿瘤方法。
图5 负载PROTAC纳米药物的体内抗肿瘤效果
6. nFAK@M231和nBRD@M231对MDA-MB-231肿瘤的体内抑制作用
最后,研究了不同治疗方法对MDA-MB-231肿瘤的抑制作用。结果显示nFAK@M231或nBRD@M231结合FMD是最有效的抗肿瘤方法。
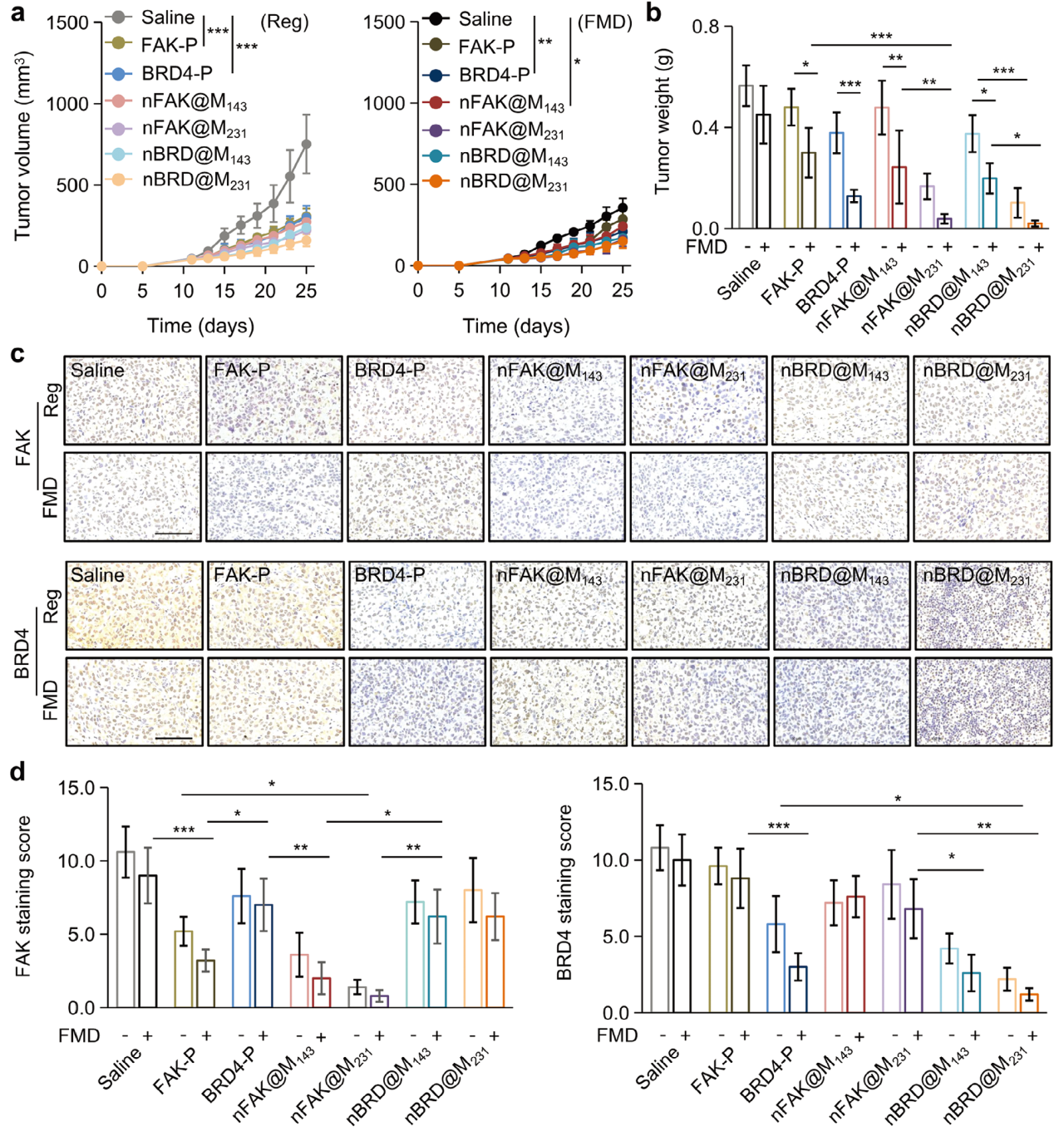 图6 nFAK@M231和nBRD@M231对MDA-MB-231肿瘤的体内抑制作用
图6 nFAK@M231和nBRD@M231对MDA-MB-231肿瘤的体内抑制作用
小结
作者基于泛素化蛋白质组学揭示了能量代谢调控可以影响肿瘤细胞的泛素化、自噬和蛋白质代谢:FMD治疗增加了肿瘤细胞中泛素化蛋白水平和蛋白酶体活性,从而显著提高FMD治疗肿瘤细胞中PROTACs对FAK和BRD4的降解效率。合成了两种类型的自体肿瘤细胞膜包被Si-Fe核壳纳米颗粒(NP@M143和NP@M231)将PROTACs靶向递送到肿瘤部位,并在FMD条件下靶向增强。作者的研究解决了游离PROTACs的局限性并提高抗肿瘤疗效。 另外用nFAK@M143,nFAK@M231,nBRD@M143或nBRD@M231治疗显示出对相应肿瘤生长的优越抑制,特别是与FMD治疗联合使用时。总之,作者的研究表明,PROTACs的蛋白质降解能力可以通过调节能量代谢和靶向给药来增强。
中科优品推荐 【中科新生命】提供多元化的、完善的翻译后修饰组学服务,技术成熟、数据可靠、分析齐全。同时可联合蛋白质组、代谢组等多个组学进行机制+表型完整的一体化研究,欢迎感兴趣的老师前来咨询。