上海中科新生命生物科技有限公司
18 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Sci Transl Med(IF15.8)| 多平台构建脑脊液蛋白质共表达网络,解析与托莫西汀治疗阿尔茨海默症相关的蛋白质变化
206 人阅读发布时间:2024-08-15 15:22

蛋白质是基因功能的直接执行者,相比于基因组和转录组,基于蛋白质标志物进行临床大队列研究具有更佳的广泛性、针对性和临床相关性。同时,蛋白质是常见的治疗靶点,可更好地促进新型诊疗方案的推广,便于临床成果转化(图1)。因此,利用蛋白变化作为指示生理状态的biomarker已在多种领域得到广泛应用,尤其在难以取得组织样本的情况下,使用血液、脑脊液、房水等样本表征大脑、眼睛等组织的发育或疾病状态已极为常见。
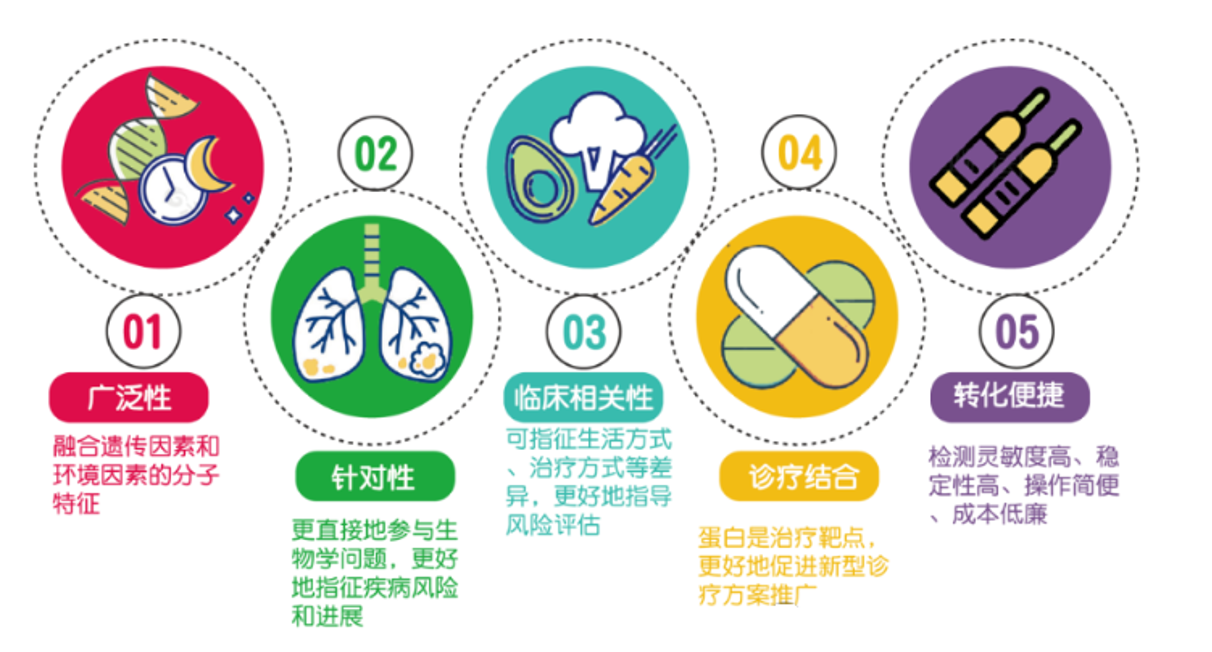
图1 蛋白质组在液体活检大队列研究中的应用优势
因着上述原因,从样本中检测出更多蛋白质是有效挖掘biomarker的关键。然而在实际应用,尤其临床研究中,蛋白质组数据挖掘仍面临多种难题:
1.队列样本个体异质性大,数据矩阵更复杂,蛋白质丰度存在多种缺失值,该如何处理?
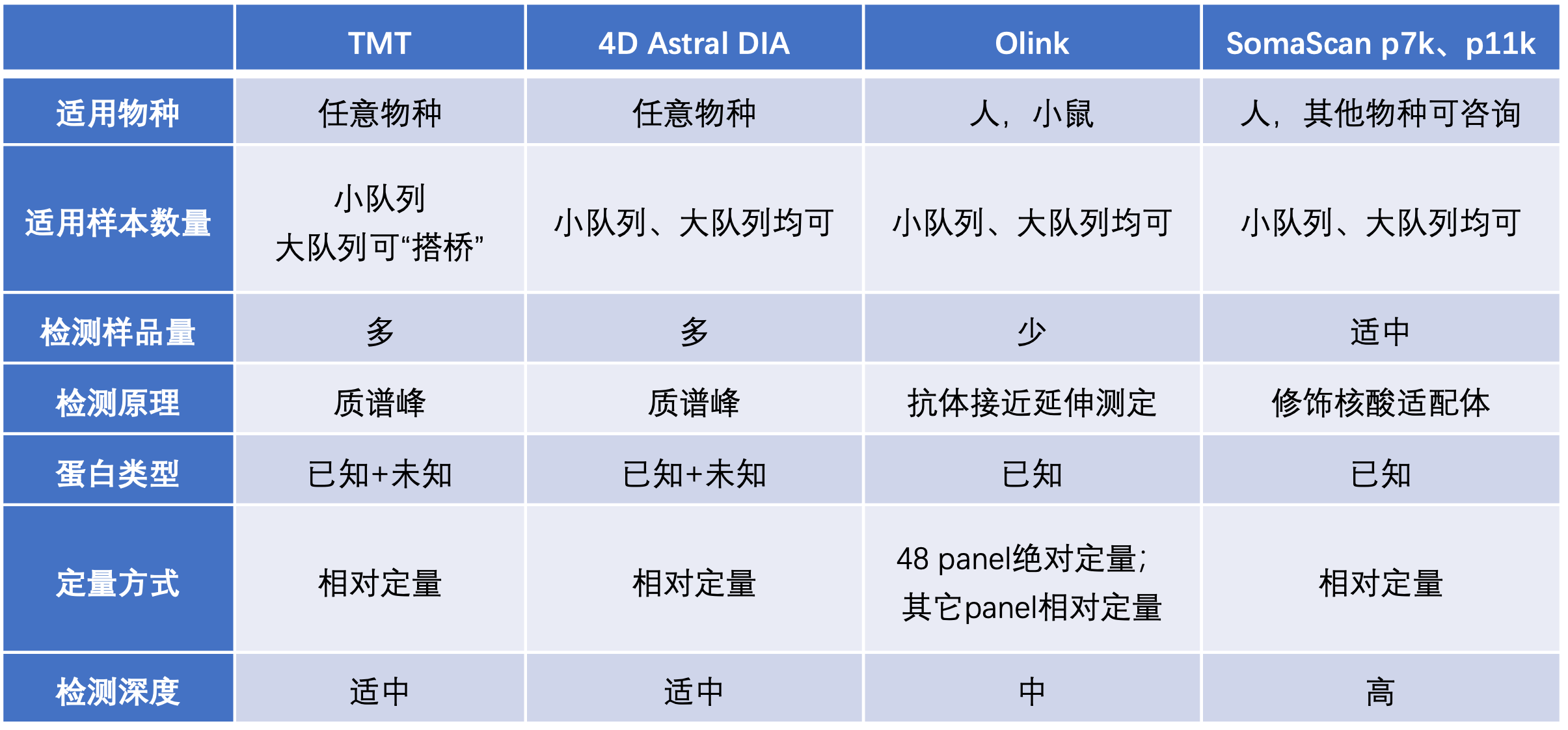
2.常见蛋白质检测平台为:质谱、细胞因子检测、Olink和SomaScan,该如何选择?
3.不同检测平台对蛋白质种类检出是否有差异性?检测结果能否整合分析?
4.蛋白质变化能否反映出常规病理指标未反应的群体异质性?
不妨带着这些疑问,看看2024年6月发表在Science Translational Medicine(IF 15.8)杂志上一篇题为“Proteomic analysis of Alzheimer's disease cerebrospinal fluid reveals alterations associated with APOE ε4 and atomoxetine treatment”的阿尔茨海默症研究中,研究者是如何解决上述问题的。

研究背景
技术路线
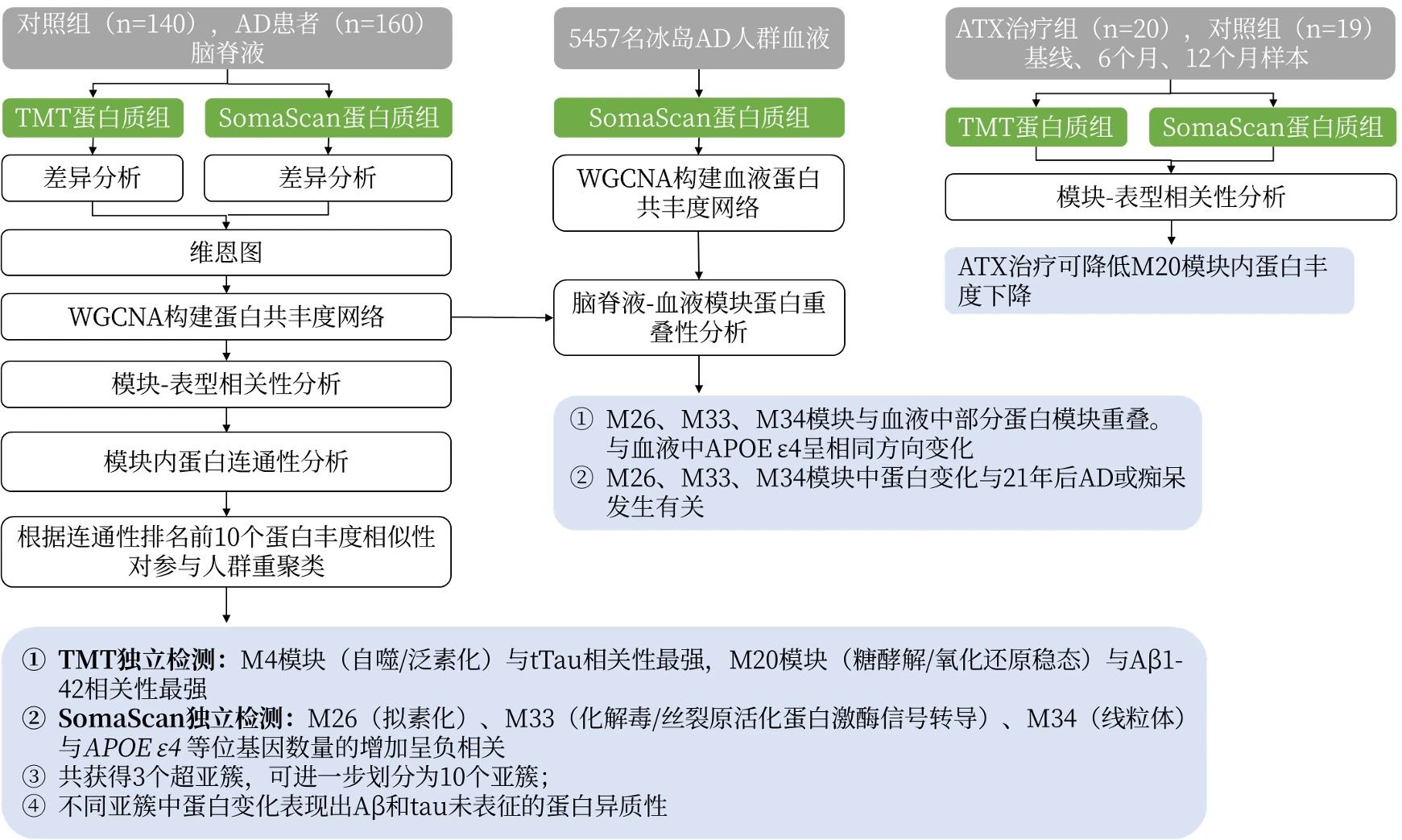
研究结果
1. TMT-MS和 SomaScan在脑脊液蛋白质检测种类和变化趋势上存在相关性
为更全面准确表征脑脊液中蛋白质的变化,分别使用TMT分级建库和SomaScan对脑脊液进行检测。在进行一系列质控并剔除75%的样本中都未检出到的蛋白质后,最终获得4576种蛋白质,其中SomaScan 3649种,TMT 2195种。维恩图表明,有1268种蛋白在两种平台中均被检测到(图2)。同时,两种平台分别有特异性蛋白质检出。对蛋白种类进行剖析,发现TMT-MS优先测量补体蛋白和免疫球蛋白,而SomaScan优先测量核蛋白。
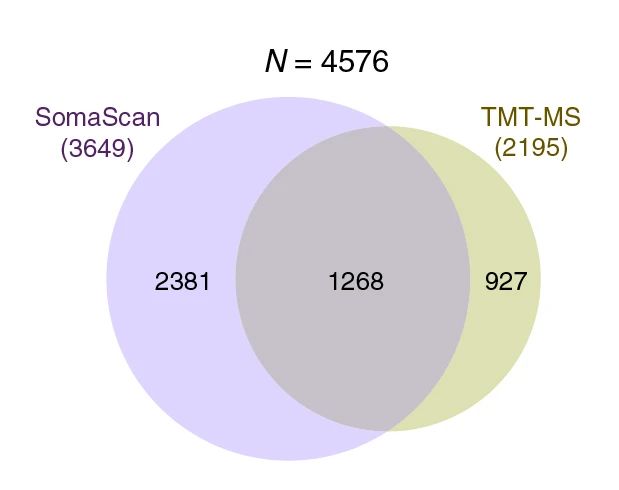
图2 两种检测平台在检测蛋白质种类上的比较
注:质控方式:去除数据背景噪音、矫正TMT检测批次效应、过滤低信号检测值、去除在75%的样本中丰度缺失的蛋白质
从蛋白质丰度角度比较两种检测平台差异,无论是SomaScan还是TMT-MS,AD中增加的蛋白质数量相似,两个平台之间的重叠约为21%,更多下调蛋白被SomaScan检出(图3)。整体结果表明,每种平台优先测量的脑脊液蛋白质各有差异,两平台间的蛋白质信息可互补。
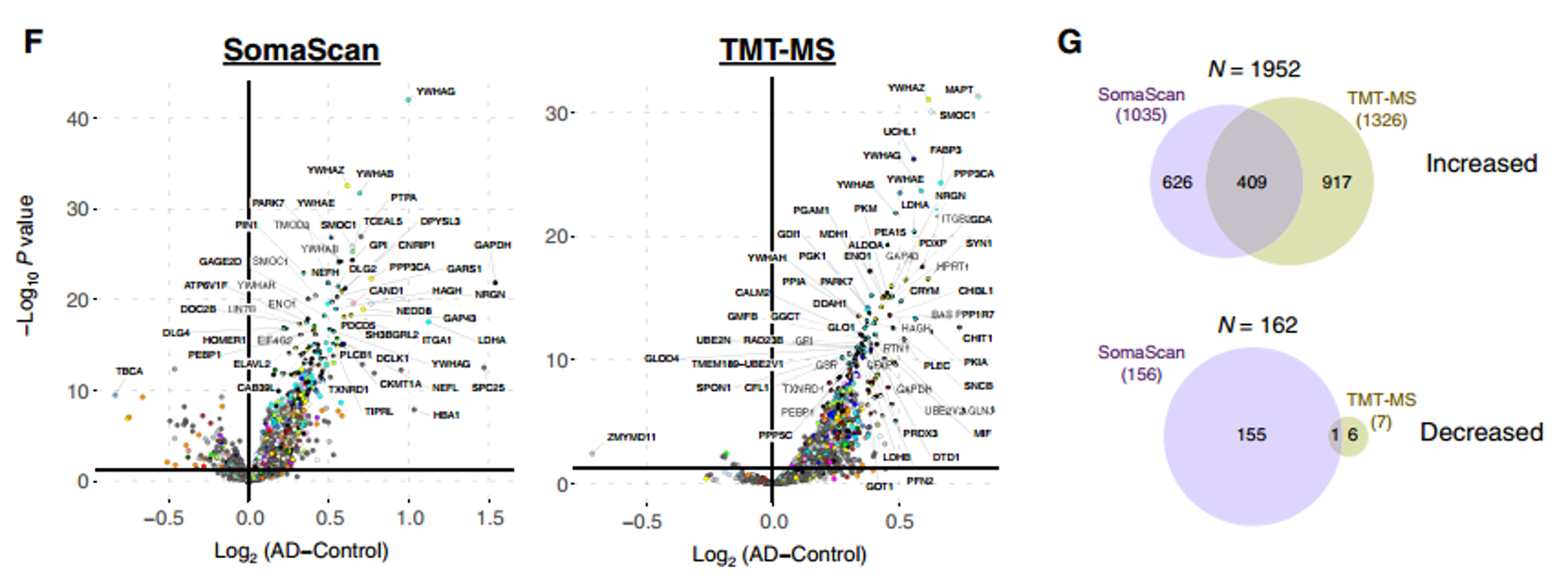
图3 从蛋白质丰度角度比较SomaScan与TMT-MS检测差异
注:F:两种平台结果(SomaScan,TMT-MS)分别进行差异分析得到差异火山图;G:两平台中共有上调或下调蛋白;
2. 整合两组学蛋白质丰度,构建高深度AD患者脑脊液蛋白质共丰度网络
由于SomaScan与TMT-MS检测到的蛋白质种类存在互补性,为更深度全面剖析脑脊液蛋白质组变化特征,研究者根据两平台共有蛋白测量值中位数信息,整合两种检测平台得到的蛋白质相对丰度,构建AD患者脑脊液蛋白质共表达网络。最终得到由34个模块组成的网络(图4A)。多数模块与AD至少一种表型指标相关,如M4模块(自噬/泛素化)与tTau相关性最强,M20模块(糖酵解/氧化还原稳态)与Aβ1-42相关性最强(图4B,D)。上述两个模块内蛋白均通过TMT-MS测量。
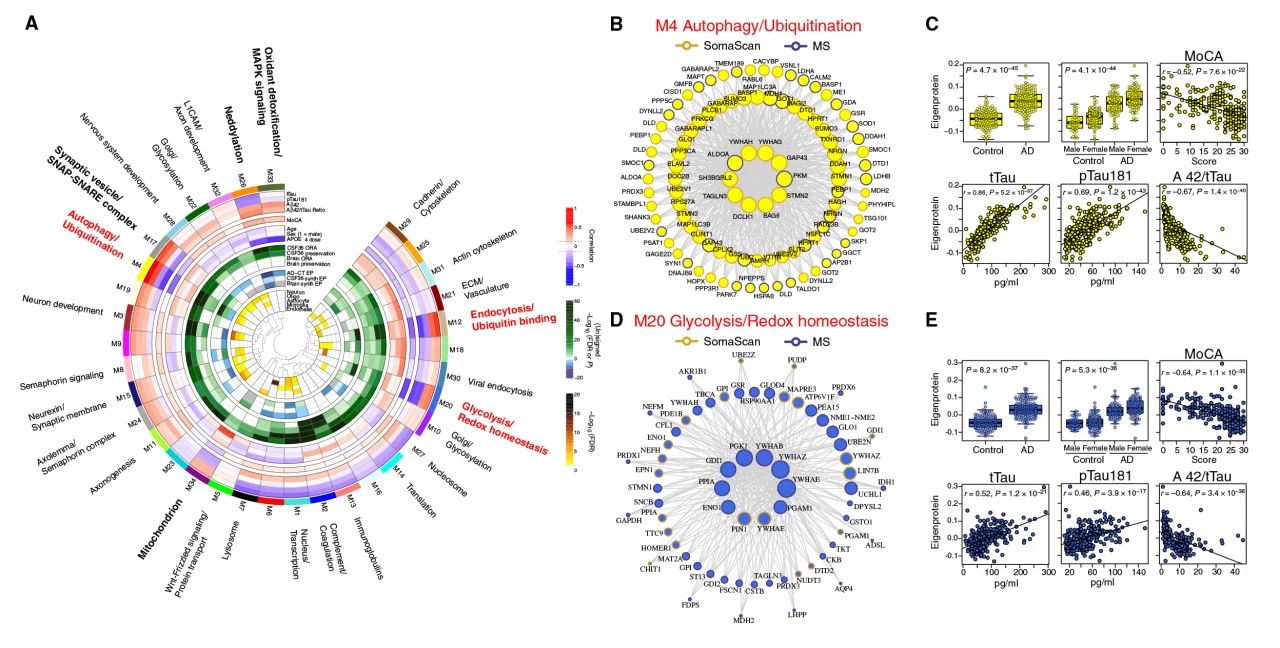
图4 SomaScan,TMT-MS平台蛋白质共表达网络
载脂蛋白E ε4(APOE ε4)基因型是迟发性AD的最强遗传风险因素,研究者发现与APOE ε4等位基因数量高度相关的三个模块由SomaScan独立检测得到,分别为M26(拟素化)、M33(氧化解毒/丝裂原活化蛋白激酶信号转导)和M34(线粒体)。其中M26、M33模块内蛋白在AD患者中下降并与APOE ε4等位基因数量的增加呈负相关(图5A-D)。而M34模块在AD和APOE ε4中显著增加,与认知功能、tTau和pTau181以及Aβ1-42有适度的相关性(图5E,F)。QTL分析表明,上述三类模块受APOE ε4基因型影响,并在另一项5400名冰岛队列的血清样本中发现,这三种模块与血清中的部分蛋白模块存在重叠。整体结果表明,可利用SomaScan和TMT-MS构建AD脑脊液蛋白共表达网络,该网络揭示Aβ和tau失调间的多种病理变化,包括APOE ε4基因型控制下的变化,并且脑脊液共表达捕获的神经元生物学特征可部分反映在血清中。
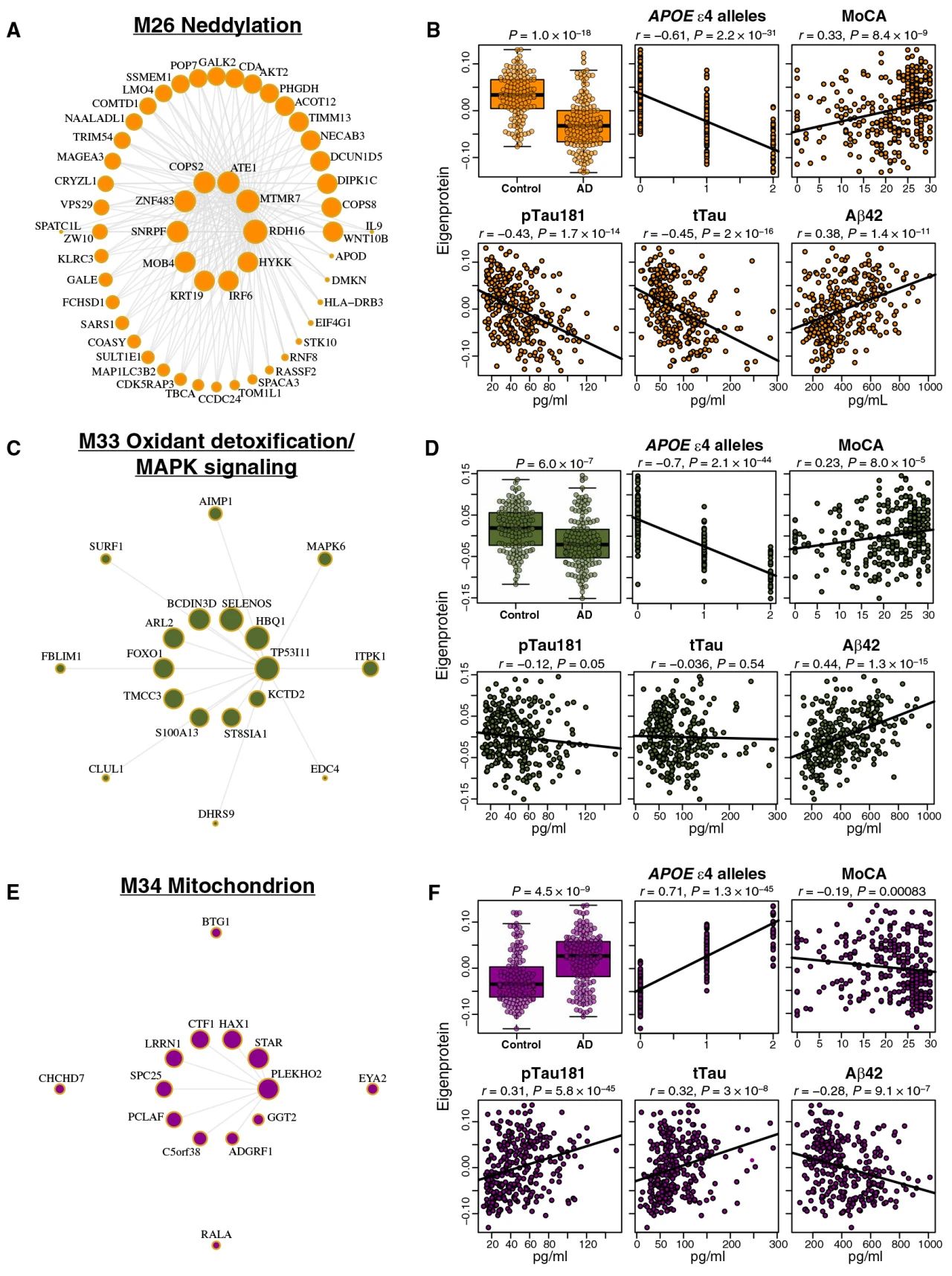
图5 AD脑脊液网络模块与APOE ε4等位基因数量相关
3. 血液中M33氧化解毒/MAPK信号和M34线粒体模块与诊断前至少21年发生的痴呆相关
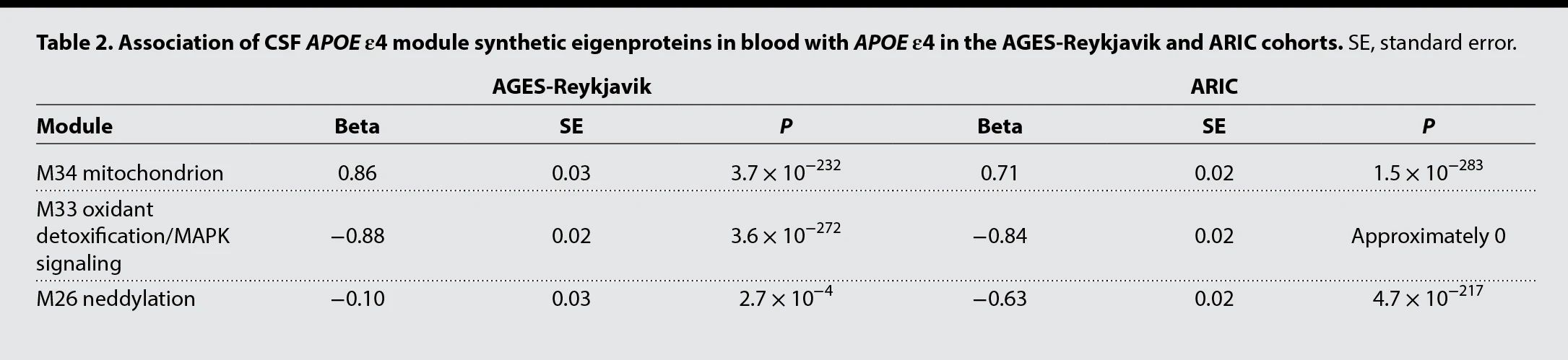
由于M26、M33和M34模块与血液中部分蛋白模块重叠,为进一步确定这些蛋白是否与血液中APOE ε4相关?作者在一项纵向队列研究中(5457名冰岛人),使用SomaScan检测血清蛋白,发现三种APOE ε4模块特征蛋白(模块第一主成分蛋白)与血清APOE ε4的相关方向、脑脊液中APOE ε4的相关方向相同,其中M33和M34的相关性特别强(表1)。且M33和M34与流行AD和偶发AD都有关联。
表1 AGES-Reykjavik和ARIC队列中,血液中脑脊液APOE ε4模块合成蛋白APOEε4的关联
同样,作者在一项社区动脉粥样硬化风险(ARIC)研究中测试了血浆中得到的脑脊液模块特征蛋白与APOE ε4,痴呆发生率的关联。发现在平均21年的随访中,三个模块都与痴呆的发生有关(图6)。整体结果表明,在脑脊液中观察到的与APOE ε4密切相关的蛋白(M26、M33、M34)也与血液中APOE ε4呈相同方向变化,且这些模块内的蛋白在血液中的丰度变化与21年后AD或痴呆发生相关。
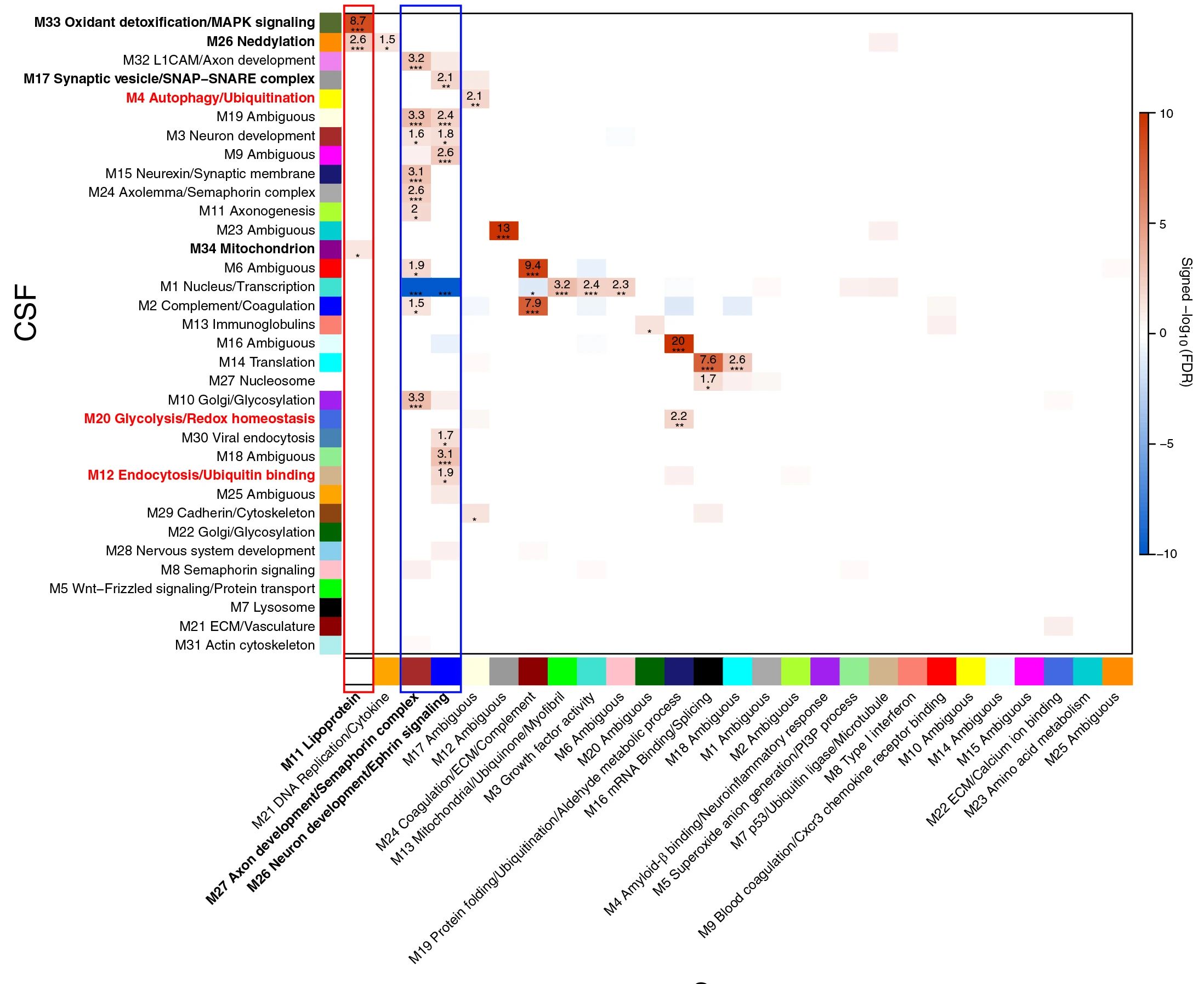
图6 脑脊液AD网络与血液蛋白质网络重叠
4. AD患者的脑脊液蛋白质网络模块受ATX治疗的影响
既然脑脊液的蛋白质共表达模块可深入了解AD病理生理的不同差异。在临床治疗干预下,这种共丰度网络是否受到影响?若受到影响,治疗后产生的变化能否转化为临床诊疗标志物?
随后,研究者使用去甲腺素再提取抑制剂(ATX)治疗因AD引起的轻度认知障碍患者,在治疗前后收集脑脊液样本进行TMT-MS和SomaScan检测,并将ATX比率(n=18 ATX/安慰剂和n=16 ATX/基线,总n=34)与患者内部安慰剂与基线比率(安慰剂/基线,n=18)进行比较,以衡量由ATX引起的治疗效果。发现4个模块受到ATX治疗的影响,分别为M20(糖酵解/氧化还原稳态)、M21(细胞外基质(ECM)/血管系统)、M14(翻译)、M16(歧义)。其中M20与AD内表型密切关联,由65种蛋白质构成,在AD中强烈升高,ATX治疗6个月后,M20模块内蛋白丰度下降较大,以增加大脑代谢功能(图7)。
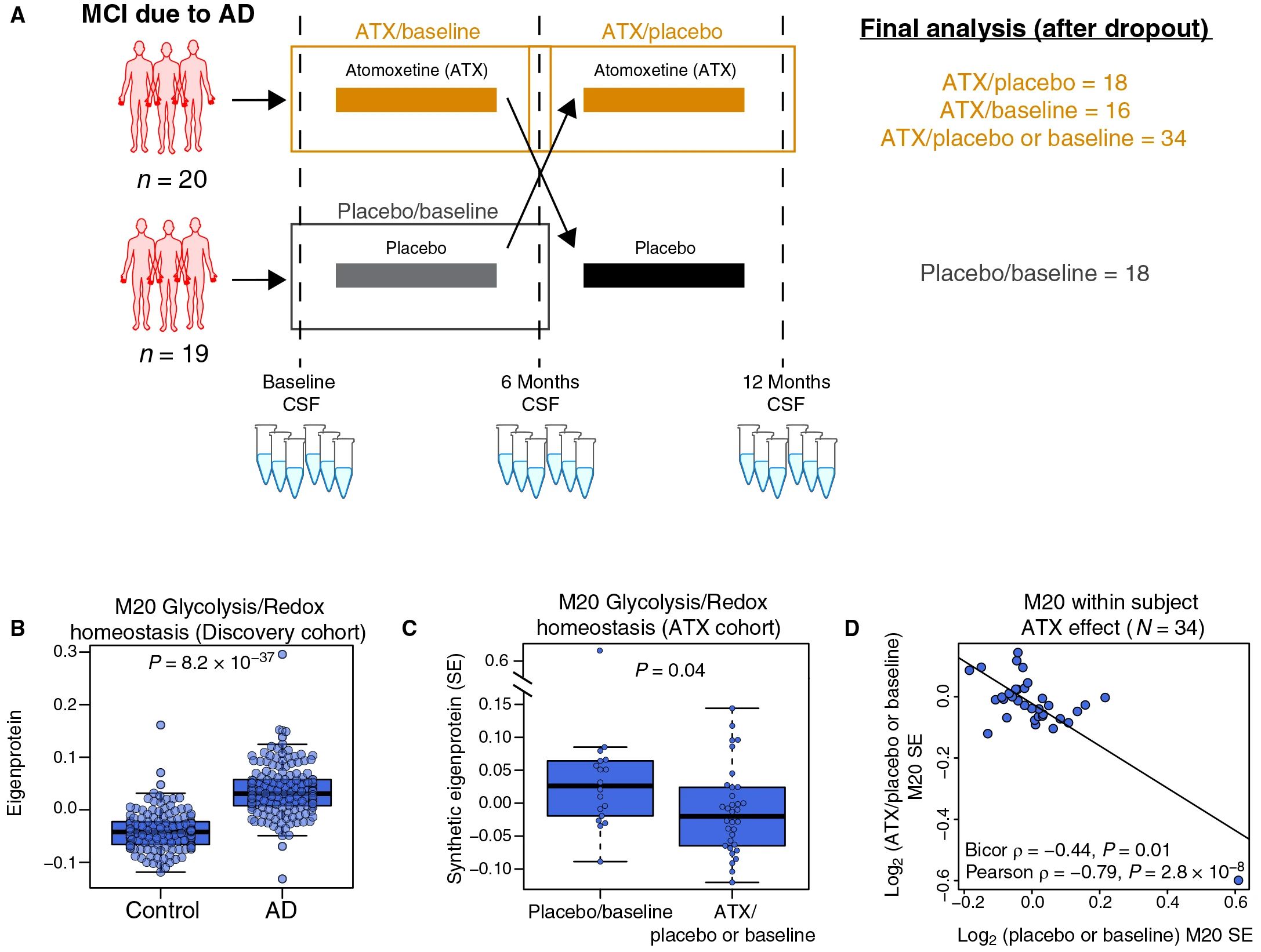
图7 ATX治疗对AD CSF网络模块的影响
研究者进一步利用8种蛋白质的组成比例预测M20模块内蛋白变化,发现其有良好的预测效果。整体结果表明,ATX治疗可改变因AD引起的认知障碍患者脑脊液蛋白共丰度网络,且这种变化可通过M20模块蛋白或M20模块应答蛋白的比率进行预测。
5. 脑脊液蛋白共丰度网络发现Aβ、tau未表征的病理异质性
为从蛋白水平对参与者再次分组,对每个模块内连通性前10的枢纽蛋白进行聚类可将296名参与者重新分为10个亚组,并根据蛋白丰度相似性将10个亚簇再次聚集为3大超簇(图8)。比较不同亚簇中参与者的Aβ、tau特征发现,第10亚簇群体具有基于Aβ和tau诊断标准的统一成员。第3,6亚簇蛋白丰度相似性与第10组关系最为密切,属同一超簇,但在关键蛋白上存在一定差异,如:神经元模块M8(信号蛋白信号)、M15(神经素/突触膜)、M24(轴膜/信号蛋白复合物)、M11(轴突);APOE相关模块:M33(氧化解毒/MAPK信号)和M26(类泛素化)的蛋白丰度在3和6亚簇人群中更高,而M34(线粒体)的丰度较低(图8)。
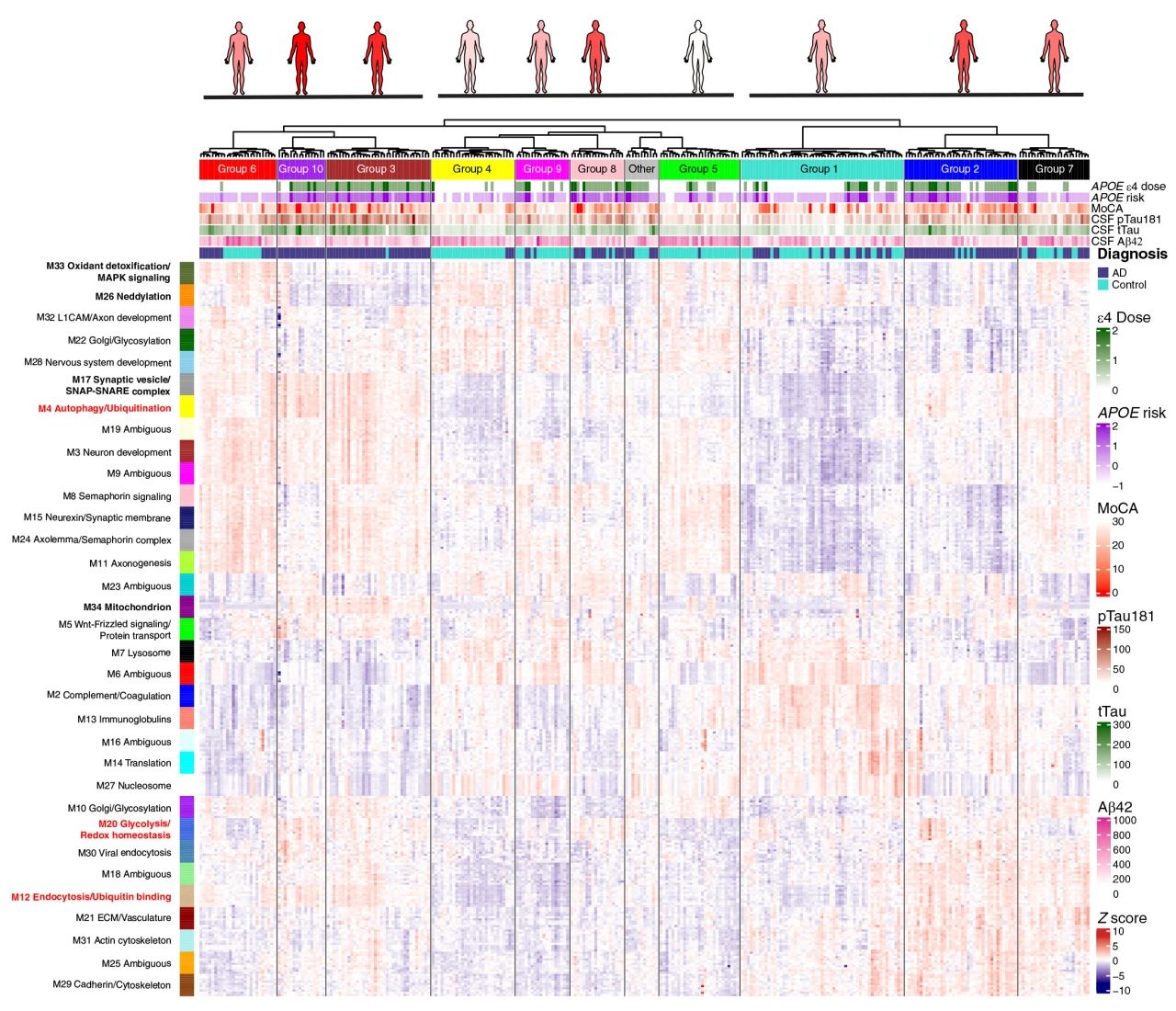
图8 基于CSF AD蛋白质组网络特征对个体进行分组
第1,2,7组在第二超簇中,包含基于Aβ和tau标准的AD和对照人群,一些关键的脑脊液蛋白特征上存在不同,包括上述神经元模块和M4(自噬/泛素化)丰度较低,M2(补体/凝血)丰度较高;第4、5、8和9亚簇组成第二类超簇,这一超簇中既有由Aβ,tau定义的对照病例(第4组和第5组),也有高比例的AD病例。M20(糖酵解/氧化还原稳态)模块可将该超簇中AD人群和对照人群区分开(图8)。整体结果表明,基于脑脊液蛋白质组谱的个体聚类揭示了Aβ和tau未完全反应的病理变化异质性。
总结
1.不同检测平台为AD患者脑脊液中蛋白质的深度检测奠定重要基础。无论是从蛋白质种类还是丰度上,TMT-MS与SomaScan均存在一定的重叠和特异性,两平台数据可相互补充;
2.可使用TMT-MS与SomaScan共同检测到的蛋白质对两种检测方案得到的蛋白质丰度进行整合,使测到的蛋白均参与分析,构建脑脊液蛋白质共表达网络,呈现出与Aβ和tau病理相关的蛋白质组学景观。挖掘出与APOE ε4风险基因型密切相关的三个模块(M26、M33、M34),并与先前描述的血清脂蛋白模块重叠;
3.ATX 2期治疗可降低因AD引起的认知障碍患者,脑脊液中糖酵解相关模块的蛋白丰度,以减轻病状。
为更直观展现不同检测平台的差异,便于各位老师选择最适合研究目标,最具性价比的蛋白质检测产品,小编汇总了目前中科新生命的优势蛋白检测平台,以便各位老师参考。
参考文献
[1] Dammer EB, Shantaraman A, Ping L, et al. Proteomic analysis of Alzheimer's disease cerebrospinal fluid reveals alterations associated with APOE ε4 and atomoxetine treatment. Sci Transl Med. 2024 Jun 26;16(753):eadn3504.
中科优品推荐
【中科新生命】深耕组学研究20载,具备行业前沿的各类蛋白质检测平台及成熟项目经验。现推出超高深度靶向蛋白组P7k/P11k新产品,该产品基于Somascan平台,同时实现蛋白检测的深、稳、准三位一体,适用于大规模的蛋白质组分析,尤其是血液蛋白质组,突破血液蛋白组深度极限,为血液蛋白标志物的临床转化创造新的机遇,欢迎感兴趣的老师前来咨询。