上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Cancer cell (IF=48.8) | 单细胞和空间蛋白的完美碰撞!揭示免疫联合放化疗对三阴性乳腺癌治疗响应不同的反应轨迹
348 人阅读发布时间:2024-07-30 15:19
 免疫治疗对于不同的癌症来说并非都有较好的效果,即便在响应免疫治疗的癌症中也并非所有的患者都能获得临床益处。在乳腺癌中,三阴性乳腺癌(TNBC)是最具有免疫应答的亚型,同时将免疫检查点治疗(ICI)作为标准治疗的亚型。尽管如此,在转移的情况下单一免疫治疗的对TNBC的客观缓解率也仅为20%左右,因此后续的研究主要是在追求免疫治疗联合放化疗的疗效上。对于TNBC来说,抗PD-L1联合化疗在PD-L1阳性和阴性队列中都可以改善无进展生存率,这表明PD-L1并不能预测治疗效果。因此,需要更深入的了解肿瘤免疫微环境(TME)如何影响治疗反应,以便开发新的标志物以及治疗方式。
2024年1月,以西达赛奈医学中心为主的多家美国医学机构在Cancer Cell(IF=48.8)发表了题为“Single-cell and spatial profiling identify three response trajectories to pembrolizumab and radiation therapy in triple negative breast cancer”的文章。研究团队使用单细胞测序、靶向空间蛋白质组学技术,对TNBC治疗前后的肿瘤活检样本进行了空间和分子层面的检测分析,将构建的肿瘤微环境免疫图谱与免疫治疗的反应联系起来,旨在揭示治疗前细胞生态位与细胞间相互作用对于免疫治疗效果的影响。
免疫治疗对于不同的癌症来说并非都有较好的效果,即便在响应免疫治疗的癌症中也并非所有的患者都能获得临床益处。在乳腺癌中,三阴性乳腺癌(TNBC)是最具有免疫应答的亚型,同时将免疫检查点治疗(ICI)作为标准治疗的亚型。尽管如此,在转移的情况下单一免疫治疗的对TNBC的客观缓解率也仅为20%左右,因此后续的研究主要是在追求免疫治疗联合放化疗的疗效上。对于TNBC来说,抗PD-L1联合化疗在PD-L1阳性和阴性队列中都可以改善无进展生存率,这表明PD-L1并不能预测治疗效果。因此,需要更深入的了解肿瘤免疫微环境(TME)如何影响治疗反应,以便开发新的标志物以及治疗方式。
2024年1月,以西达赛奈医学中心为主的多家美国医学机构在Cancer Cell(IF=48.8)发表了题为“Single-cell and spatial profiling identify three response trajectories to pembrolizumab and radiation therapy in triple negative breast cancer”的文章。研究团队使用单细胞测序、靶向空间蛋白质组学技术,对TNBC治疗前后的肿瘤活检样本进行了空间和分子层面的检测分析,将构建的肿瘤微环境免疫图谱与免疫治疗的反应联系起来,旨在揭示治疗前细胞生态位与细胞间相互作用对于免疫治疗效果的影响。

实验设计
50名TNBC患者纳入临床试验,分别在接受pembro和局部病灶放疗联合治疗之后进行标准化疗与手术。每次治疗前收集活检样本,直至最终手术治疗切除肿瘤或者乳房组织。总共34名患者的活检样本得以评估,使用 scRNA-seq 分析了来自 34 名患者的 50多万个细胞,以及27名患者CODEX空间单细胞蛋白组检测的540多万个细胞的空间信息。
研究结果
1. TNBC活检穿刺样本的细胞空间结构
TNBC活检穿刺样本的细胞空间图谱构建所用数据来源于两部分:
单细胞转录组:穿刺样本顶部和底部1/3被分离成单细胞悬液后,通过磁珠分离CD45+和CD45-的活细胞部分用于单细胞测序,CD45+样本同时进行了单细胞免疫组库测序(scTCR/BCR-seq)。
空间蛋白质组:穿刺样本剩余1/3,福尔马林固定后石蜡包埋,通过CODEX空间蛋白组平台的panel A(18个蛋白的靶向检测)方案对石蜡切片进行分析。
研究团队开发并利用了一种神经网络模型构建了12个空间区域(districts),这些不同细胞类型组成的结构在活检样本中多次出现。包括:上皮细胞占比89%的d0、d1、d5 和 d11,d2 和 d10主要为基质量细胞区,d7为内皮细胞区。d9区以78%的髓系细胞为主,其余部分CD4+T细胞为11%。d6区为10%的CD20+B细胞、13%的CD4+T细胞18%放入CD8+T细胞、19%的骨髓细胞以及37%的基质细胞组成的混合物。大多数CD138+浆细胞位于d8区,约为95%,与10%的上皮细胞、髓细胞和基质细胞共存。d3区和d4区以淋巴细胞为主,其中d3区含CD4+T达39%,含CD8+T达41%,d4区含B细胞最多为54%。
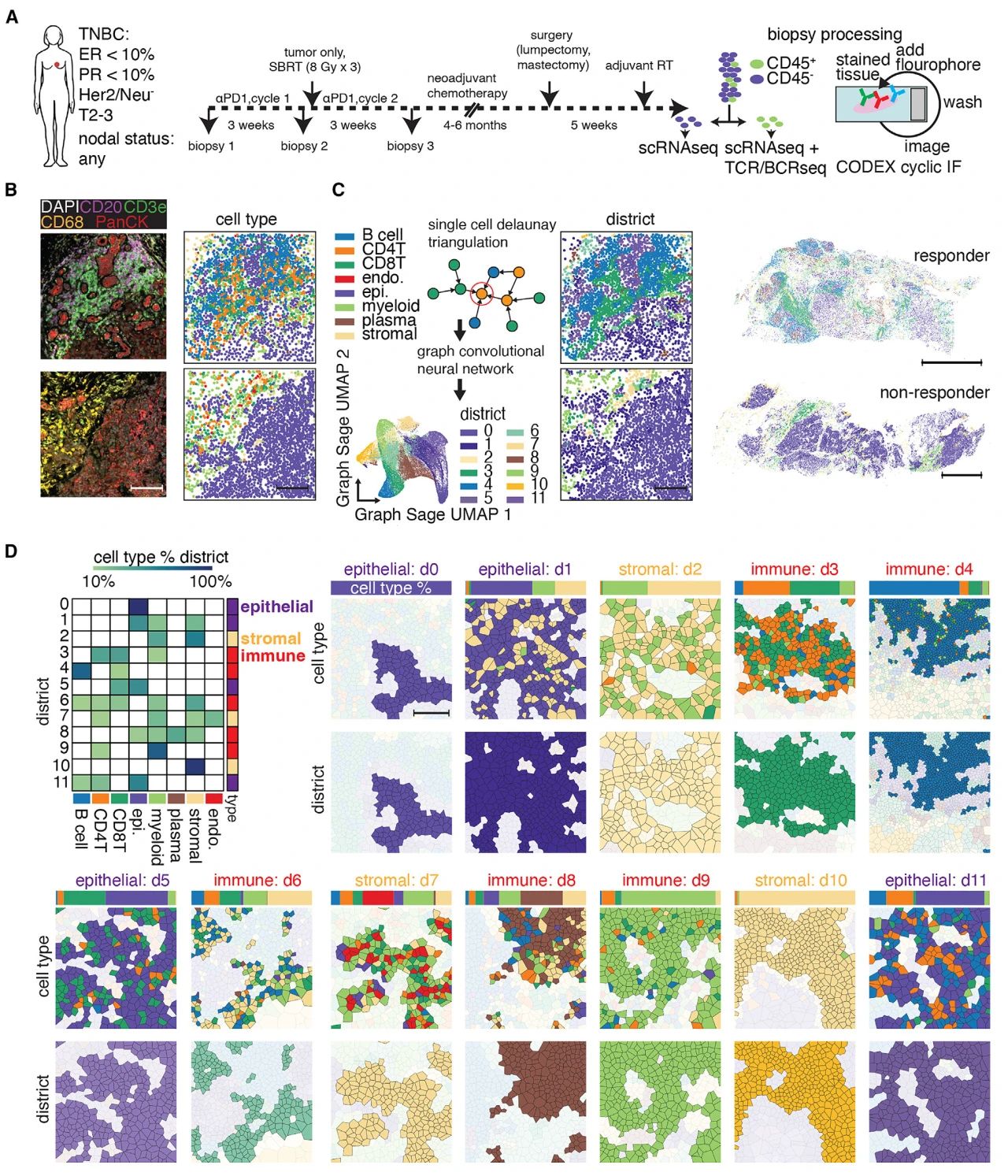 图1 TNBC穿刺活检样本中的细胞图谱
2. 治疗诱导响应性 TNBC 免疫微环境的重塑
通过不同治疗时间节点中的空间样本分析细胞的相对比例(占总细胞的百分比)以及细胞密度 (每单位面积的细胞数)。结果发现,在基线时免疫细胞的总比例并不区分响应治疗,但响应治疗的患者免疫细胞密度较高。B 细胞占主导地位的区域 d4 是基线时响应治疗中唯1比例和密度均较高的区域,富含T细胞的d6也在基线时更密集。免疫区d3、d6、d8 和d9的比例仅在响应免疫联合治疗(RTPD1)后的样本中增加,其中d3和d6 的比例和密度都高于非响应治疗患者。相反,RTPD1 后响应者中的上皮区 d0、d1 和 d11消失,而非响应治疗患者中没有变化。AUROC分析发现了类似的趋势,在治疗前d4是唯1与应答相关的区(AUROC > 0.75),但在RTPD1治疗后,所有免疫富集区(d3, d4, d6, d8和d9)按比例和密度在应答者中富集。这些结果说明了治疗重塑了TNBC的免疫微环境。
图1 TNBC穿刺活检样本中的细胞图谱
2. 治疗诱导响应性 TNBC 免疫微环境的重塑
通过不同治疗时间节点中的空间样本分析细胞的相对比例(占总细胞的百分比)以及细胞密度 (每单位面积的细胞数)。结果发现,在基线时免疫细胞的总比例并不区分响应治疗,但响应治疗的患者免疫细胞密度较高。B 细胞占主导地位的区域 d4 是基线时响应治疗中唯1比例和密度均较高的区域,富含T细胞的d6也在基线时更密集。免疫区d3、d6、d8 和d9的比例仅在响应免疫联合治疗(RTPD1)后的样本中增加,其中d3和d6 的比例和密度都高于非响应治疗患者。相反,RTPD1 后响应者中的上皮区 d0、d1 和 d11消失,而非响应治疗患者中没有变化。AUROC分析发现了类似的趋势,在治疗前d4是唯1与应答相关的区(AUROC > 0.75),但在RTPD1治疗后,所有免疫富集区(d3, d4, d6, d8和d9)按比例和密度在应答者中富集。这些结果说明了治疗重塑了TNBC的免疫微环境。
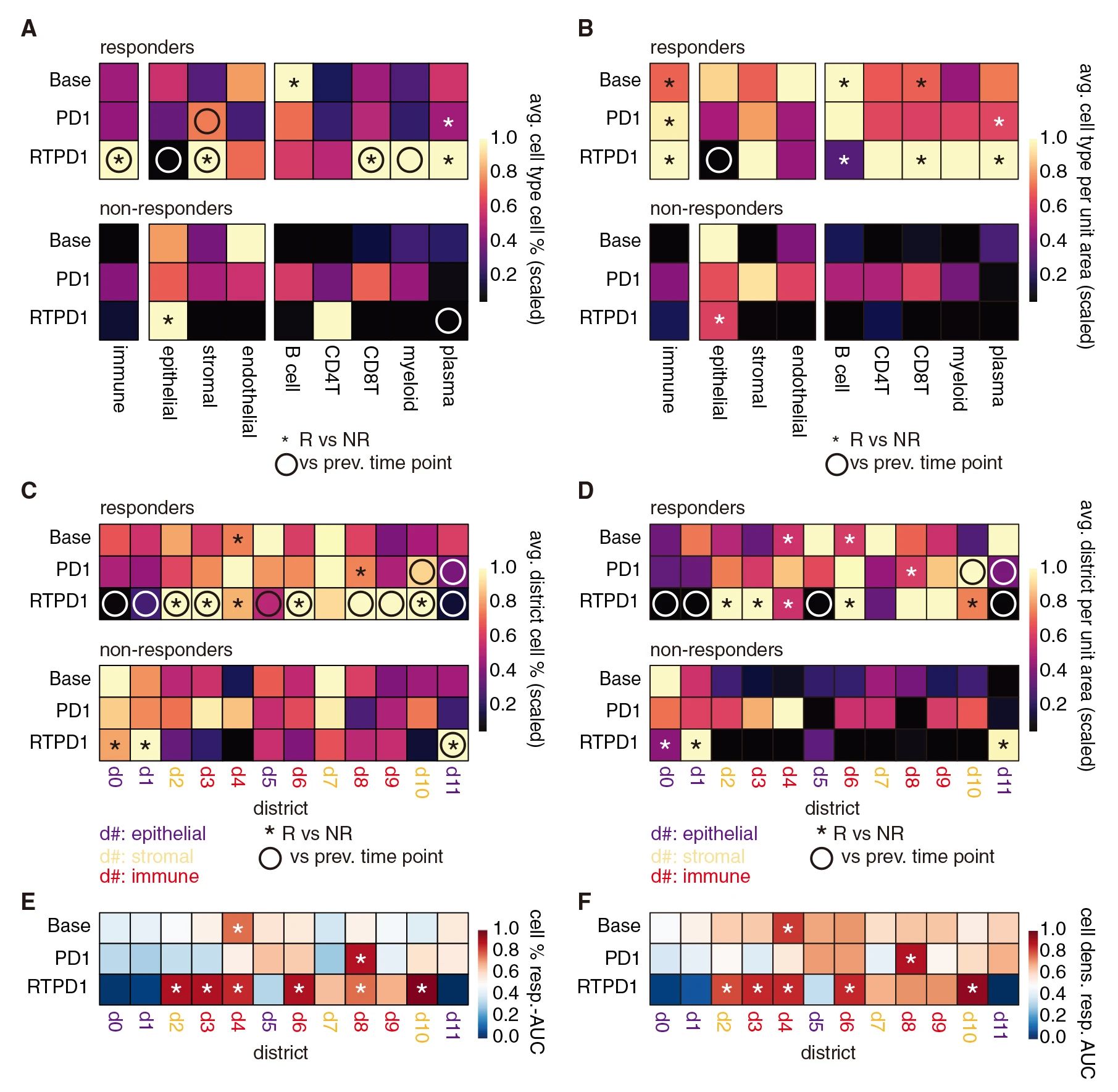 图2 治疗响应过程中的细胞结构区域变化
3. 不同治疗时间节点下活检样本的单细胞数据
此处研究团队分析了配对的CD45+细胞的单细胞转录组数据。通过Leiden聚类鉴定了B细胞/浆细胞、T 细胞、髓细胞和肥大细胞。并且通过差异基因表达分析 (DGEA) 和 CellTypist对 B细胞/浆细胞、T 细胞和髓细胞进行了亚群分析。在亚细胞水平上,T/NK细胞共分为8个亚群,其中sc-b0、sc-b2 亚群与 d4 的关联性最高。效应 T 细胞亚群 sc-t4 和 sc-t6 与 T 细胞区 d3、d6、d8 和 d9 表现出更强的相关性。d8和 d9 与效应T细胞相关,也与抗原呈递巨噬细胞亚群相关。此外spearman相关性分析还发现了空间蛋白细胞识别的细胞亚群与单细胞的结果存在一致性,包括d4中的B细胞与scRNA-seq 数据集中 B细胞的丰度相关性最强,以及scRNA-seq 中T细胞丰度与 T 细胞富集区 d3、d6 和 d9 相关。
图2 治疗响应过程中的细胞结构区域变化
3. 不同治疗时间节点下活检样本的单细胞数据
此处研究团队分析了配对的CD45+细胞的单细胞转录组数据。通过Leiden聚类鉴定了B细胞/浆细胞、T 细胞、髓细胞和肥大细胞。并且通过差异基因表达分析 (DGEA) 和 CellTypist对 B细胞/浆细胞、T 细胞和髓细胞进行了亚群分析。在亚细胞水平上,T/NK细胞共分为8个亚群,其中sc-b0、sc-b2 亚群与 d4 的关联性最高。效应 T 细胞亚群 sc-t4 和 sc-t6 与 T 细胞区 d3、d6、d8 和 d9 表现出更强的相关性。d8和 d9 与效应T细胞相关,也与抗原呈递巨噬细胞亚群相关。此外spearman相关性分析还发现了空间蛋白细胞识别的细胞亚群与单细胞的结果存在一致性,包括d4中的B细胞与scRNA-seq 数据集中 B细胞的丰度相关性最强,以及scRNA-seq 中T细胞丰度与 T 细胞富集区 d3、d6 和 d9 相关。
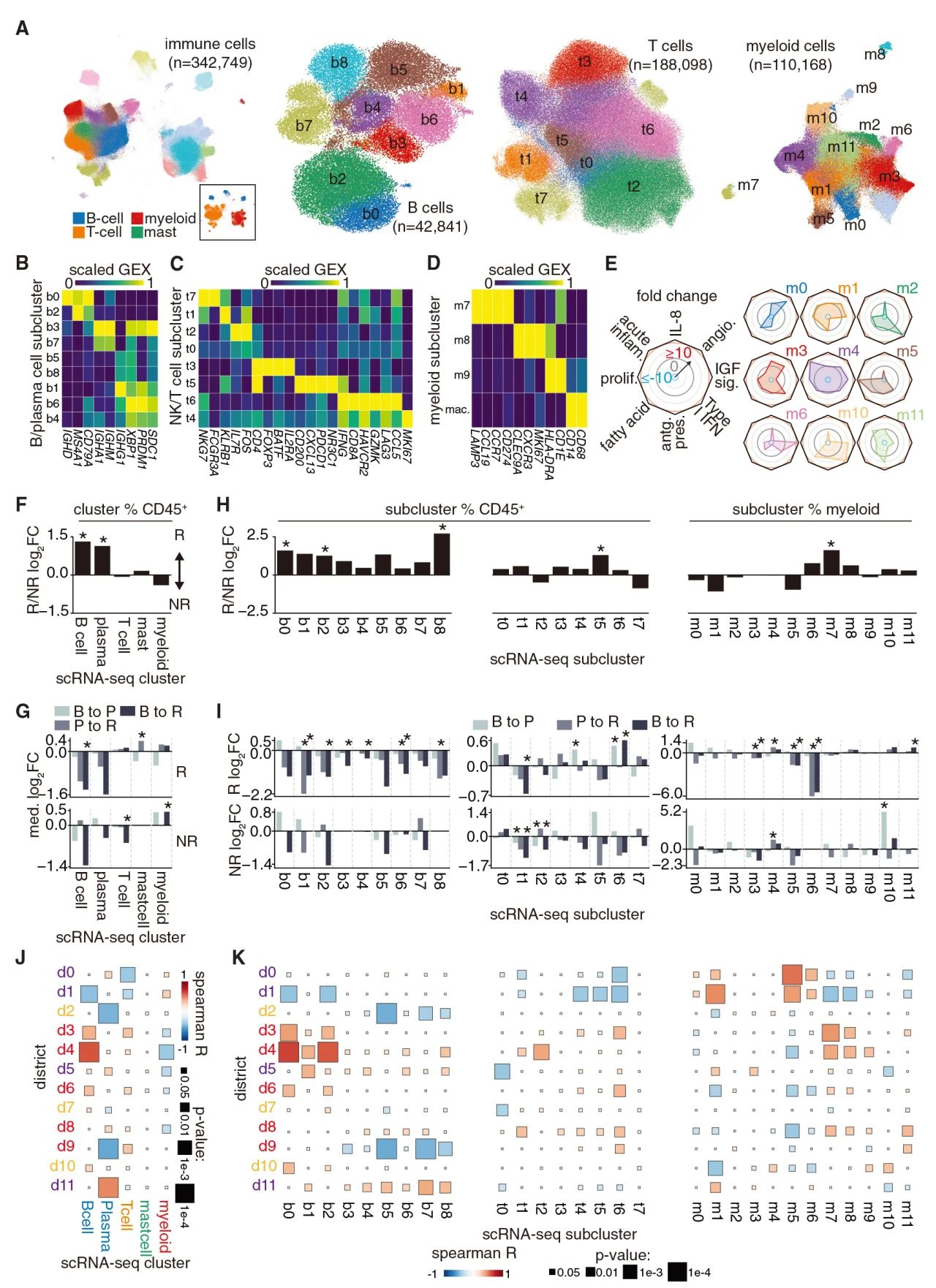 图3 与治疗响应和空间特征相关的细胞群
4. 效应T细胞扩增与抗原呈递巨噬细胞相关
CD8+T细胞作为事实上的新抗原反应效应识别器(neoTCR8),其在sc-t4和sc-t6表现出最高的表达水平,并且这种特征在治疗响应患者的早期活检中最高。仅在治疗响应患者中,这些效应T细胞亚群在anti-PD-L1后扩张增加,其中sc-t6在RTPD1后持续扩张。此外,在两个治疗阶段的活检中,治疗响应患者的sc-t6扩增高于无响应患者。另外对于T细胞的空间分布来说,治疗响应患者的上皮细胞附近具有更多的T细胞相邻。至于其他细胞表型,sc-b6 浆细胞、sc-m7 DC 和 sc-m11 巨噬细胞比例与效应T细胞的克隆扩增相关。
在空间结构上,通过研究空间区域的相关性,发现d3和d4在其空间模式上是相关的,并且d6也与这两个区域以及基质富集的d2和d10相关。d8区与其他区无空间联系,而d9区与d3区和d6区均有空间联系。这些区域间的空间相关性在治疗响应和无响应患者之间没有差异。(没有差异也是结论)
图3 与治疗响应和空间特征相关的细胞群
4. 效应T细胞扩增与抗原呈递巨噬细胞相关
CD8+T细胞作为事实上的新抗原反应效应识别器(neoTCR8),其在sc-t4和sc-t6表现出最高的表达水平,并且这种特征在治疗响应患者的早期活检中最高。仅在治疗响应患者中,这些效应T细胞亚群在anti-PD-L1后扩张增加,其中sc-t6在RTPD1后持续扩张。此外,在两个治疗阶段的活检中,治疗响应患者的sc-t6扩增高于无响应患者。另外对于T细胞的空间分布来说,治疗响应患者的上皮细胞附近具有更多的T细胞相邻。至于其他细胞表型,sc-b6 浆细胞、sc-m7 DC 和 sc-m11 巨噬细胞比例与效应T细胞的克隆扩增相关。
在空间结构上,通过研究空间区域的相关性,发现d3和d4在其空间模式上是相关的,并且d6也与这两个区域以及基质富集的d2和d10相关。d8区与其他区无空间联系,而d9区与d3区和d6区均有空间联系。这些区域间的空间相关性在治疗响应和无响应患者之间没有差异。(没有差异也是结论)
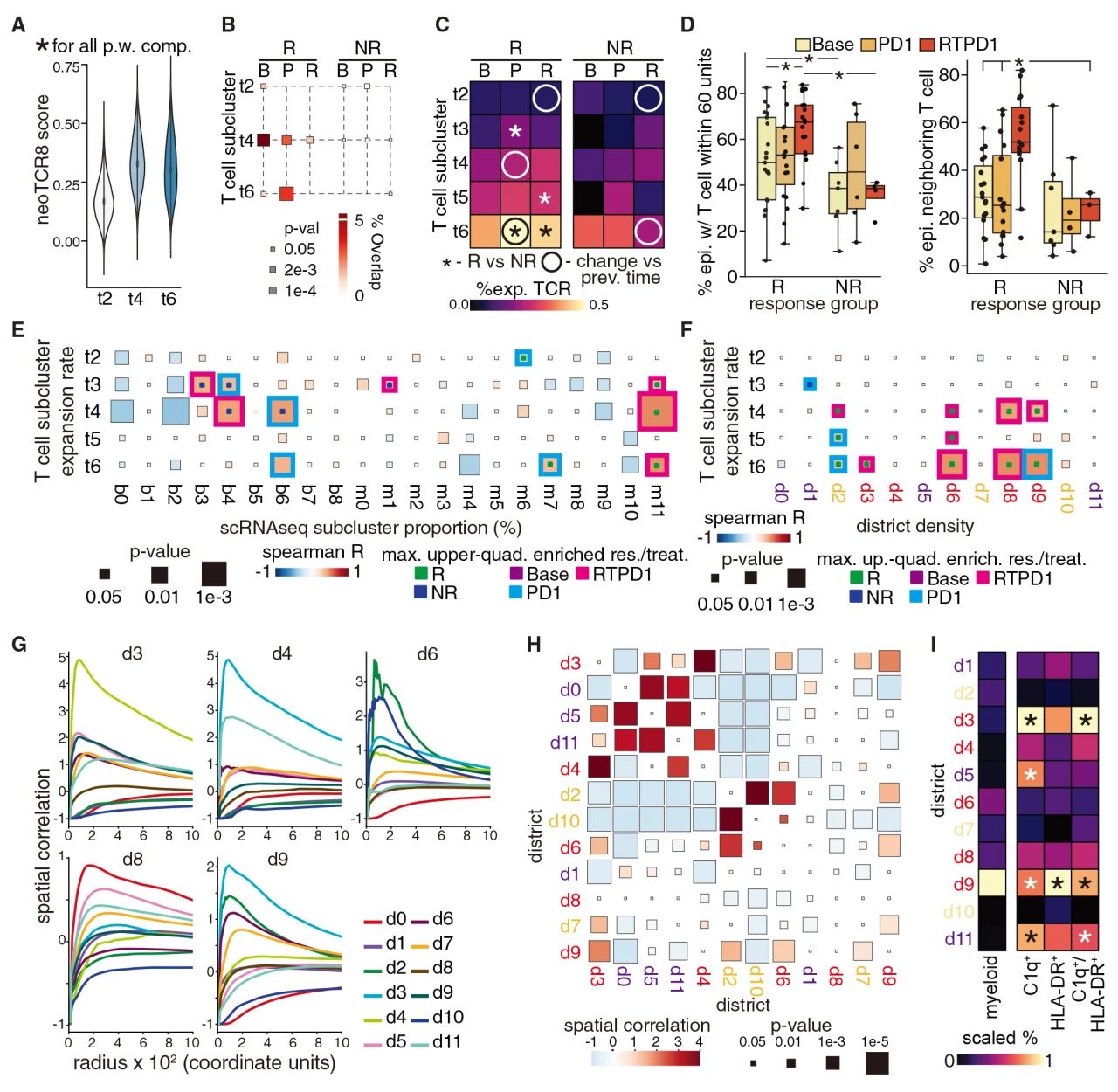 图4 T细胞克隆扩增与治疗及空间结构的
图4 T细胞克隆扩增与治疗及空间结构的
5. 鉴定具有不同免疫轨迹的两个反应者群体 治疗响应性肿瘤在与治疗响应相关的空间因素上表现出异质性。为了研究这一点,选择了活检样本最大区域的空间蛋白组结果作为代表对肿瘤进行了无监督聚类。肿瘤聚集成3组,大多数无治疗响应的肿瘤形成一个亚组,治疗响应的肿瘤形成两个亚组。将响应组称为R1,所有其他响应组称为R2,而所有无响应组称为NR,分别类似于炎症型,免疫排除型和免疫荒漠型。其中R1含有三级淋巴结构,丰富的T细胞、抗原呈递相关巨噬细胞和表达MHC I/II 类的上皮细胞,在进行免疫检查点治疗后出现T细胞扩增,并伴随上皮细胞的消除。在基线时,R2和NR不易区分,在 pembro 和 RT 后,R2 中 T 细胞、骨髓细胞和表达 MHC I/II 的上皮细胞在空间接近度和数量上增加,但 B 细胞丰度仍然较低。总的来说R2与免疫检查点抑制的典型反应组的表达相似度低,R1恶性细胞在基线时就显示出免疫治疗响应的特征。
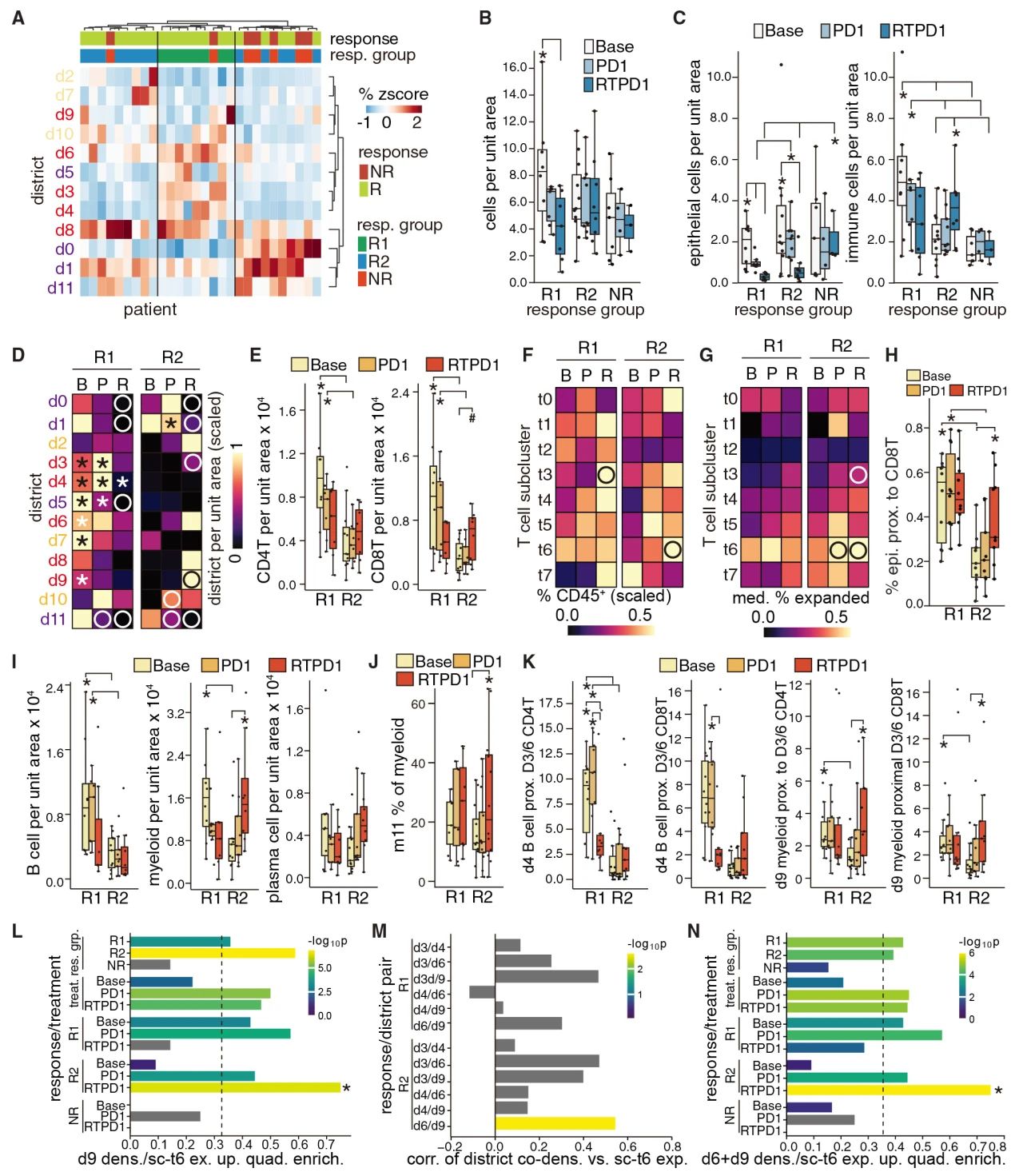 图5 治疗响应的肿瘤包含两个空间上不同的亚组
6. R1恶性细胞在基线时就显示出免疫治疗响应的特征
最后,总结分析了R1恶性细胞在基线和anti-PD-L1治疗后表达与免疫治疗反应相关的癌症基因特征,并且这些基因在RTPD1后的R2中被扩增。此外,通过对区分每种肿瘤类型的基因进行富集分析发现,R1癌细胞在基线和anti-PD-L1治疗之后具有更高的MHC I、MHC II和TAP相关基因表达,并且在治疗周期的前一次到两次活检中,这些基因在R1正常上皮细胞、成纤维细胞和血管内皮细胞中表达上调。同时这些程序在 RTPD1 后也在 R2 恶性细胞中上调,表明R2也会在整体治疗过程中收益。
图5 治疗响应的肿瘤包含两个空间上不同的亚组
6. R1恶性细胞在基线时就显示出免疫治疗响应的特征
最后,总结分析了R1恶性细胞在基线和anti-PD-L1治疗后表达与免疫治疗反应相关的癌症基因特征,并且这些基因在RTPD1后的R2中被扩增。此外,通过对区分每种肿瘤类型的基因进行富集分析发现,R1癌细胞在基线和anti-PD-L1治疗之后具有更高的MHC I、MHC II和TAP相关基因表达,并且在治疗周期的前一次到两次活检中,这些基因在R1正常上皮细胞、成纤维细胞和血管内皮细胞中表达上调。同时这些程序在 RTPD1 后也在 R2 恶性细胞中上调,表明R2也会在整体治疗过程中收益。
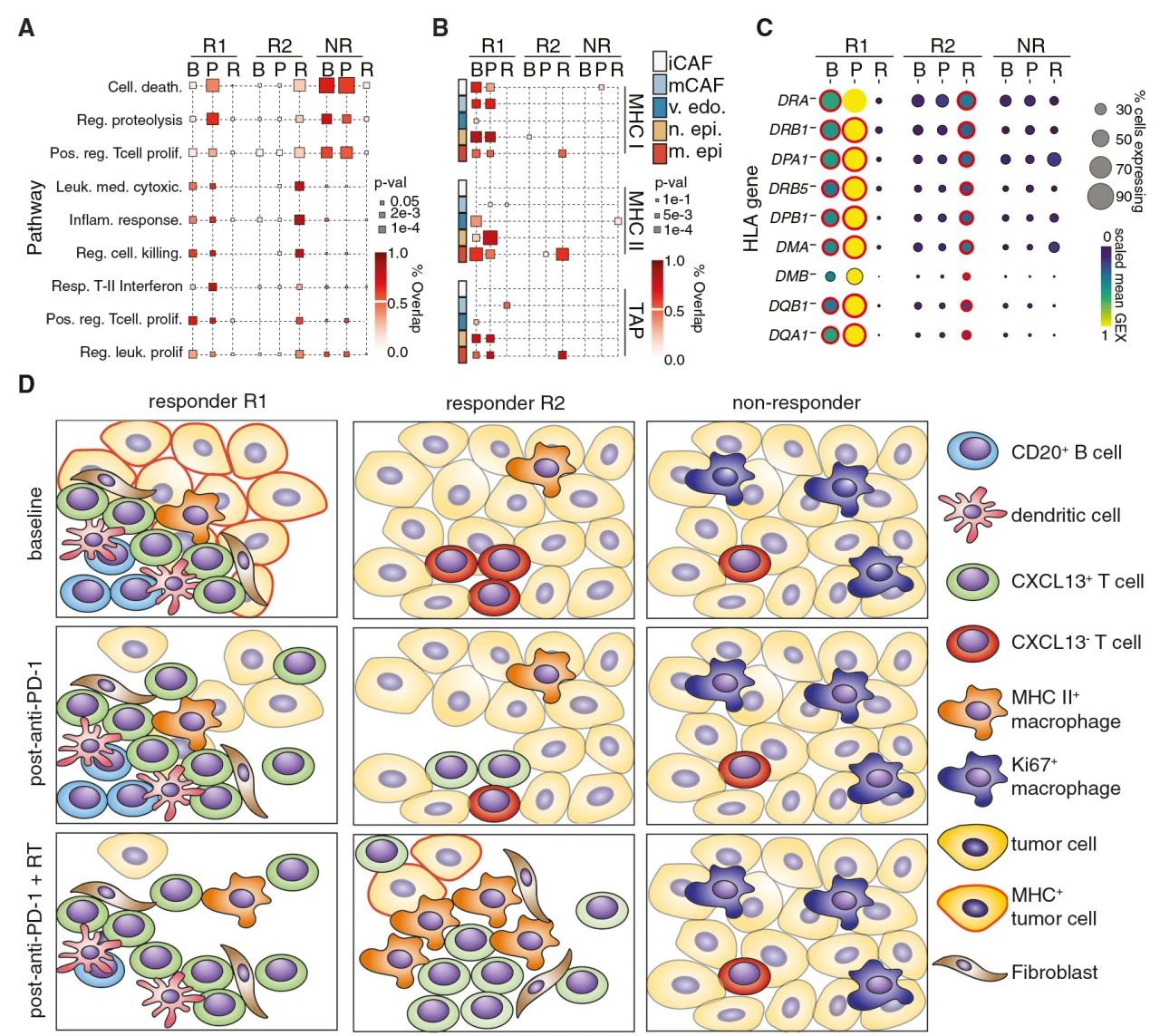 图6 指示响应治疗组的非免疫细胞特征
图6 指示响应治疗组的非免疫细胞特征
总结
该研究结合单细胞转录组测序及蛋白空间原位分析技术,分析了三阴性乳腺癌患者对于免疫/放化疗响应程度不同的内在原因。发现了三种不同的免疫反应途径,包括高免疫浸润的R1亚型、与对治疗无响应患者相似的R2亚型、以及治疗前后均缺乏免疫浸润的无响应NR亚型。这些发现揭示了对治疗响应程度不同的患者群体在免疫治疗过程中的独特免疫轨迹,为精准治疗策略提供了积极的线索。
中科优品推荐 【中科新生命】重点布局单细胞多组学平台,先后建立了基于10x Genomics Chromium X的单细胞转录组测序平台以及“一站式”单细胞蛋白质组服务平台。其中,Chromium X作为当前业内通量最高的单细胞测序平台之一,可以实现百万级细胞通量检测,为大规模单细胞图谱、高通量药物筛选、稀有细胞鉴定分析等需求提供助力。