上海中科新生命生物科技有限公司
18 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Nature genetics(IF:31.7)|深入挖掘肺纤维化未知领域!空间转录组图谱为特发性肺纤维化病理机制提供新见解!
564 人阅读发布时间:2024-07-23 13:53

特发性肺纤维化(Idiopathic Pulmonary Fibrosis,IPF)是一种慢性、进行性和不可逆的肺部疾病,其特征是肺组织逐渐被纤维化组织替代,导致肺功能下降和呼吸困难。尽管近年来在理解IPF病理生理机制方面取得了一些进展,但目前的治疗选择仍然非常有限,且多局限于延缓疾病进展,而无法治愈。传统的动物模型虽然在一定程度上能够模拟人类IPF的病理特征,但由于物种间的差异,这些模型在药物筛选和机制研究中的转化应用受到限制。
为了解决这些局限性,2024年7月来自瑞典的研究团队在Nature genetics上发表一篇题为“Mapping spatially resolved transcriptomes in human and mouse pulmonary fibrosis”的研究论文。该研究中,作者生成了人类IPF患者和博莱霉素诱导的小鼠肺纤维化模型的空间转录组图谱,为IPF的发病机制提供了新的见解。

研究材料
人类IPF(n=4)和HC正常组织(n=4);博来霉素诱导的小鼠肺纤维化BLM模型(n=6,每个时间点(7天、21天)n=3)
技术方法
空间转录组、单细胞转录组技术路线 步骤1:健康人和IPF人肺的空间转录组图谱构建; 步骤2:肺纤维化小鼠模型中的空间转录组图谱; 步骤3:人类与小鼠模型肺纤维化的差异; 步骤4:纤维化微环境研究。
研究结果 1. 健康人和IPF人肺的空间转录组图谱构建
研究团队采用10X Visium空间转录组学技术,生成了人类IPE和HC组织的空间转录组图谱,首先对HC和IPF样本进行差异分析共鉴定出了1469个差异显著的基因,这些基因与成纤维细胞相关,并且在先前研究中已被报道在IPF中上调。将差异基因映射回空间位置发现,大部分DEG位于纤维化区域,多种趋化因子在纤维化边缘高表达,而在肺泡中表达量降低。相反,细胞外基质(ECM) 相关基因(COL1A1、COL1A2 和 LUM)在纤维化边缘表达低,而在纤维化和邻近肺泡中表达高。随后通过非负矩阵分解 (NMF)和scRNA-seq联合分析确定细胞类型及特殊表达因子/基因。
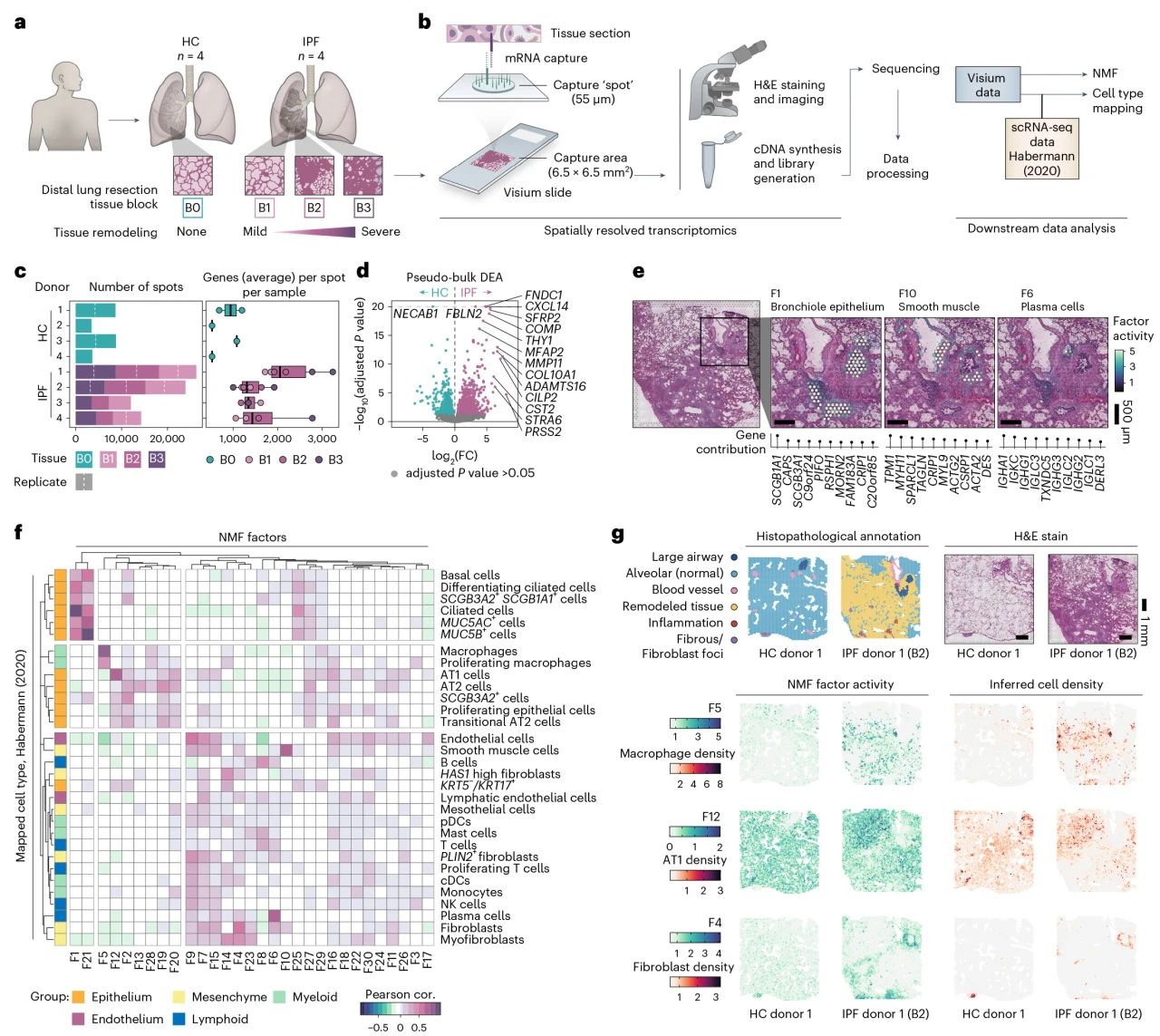
图1 人类肺纤维化的空间转录组学分析
1.1 因子活性揭示了通路和细胞相互作用
对样本间因子分布的进一步分析显示,与HC相比,IPF样本中有11个因子是普遍存在的,这些因子对IPF细胞的形态和疾病过程起到关键性作用,其中F9是特殊存在于纤维化密度较低的IPF样本中('B1'),表达与氧化应激、炎症、ECM 重塑和血管变化相关的基因,表明F9参与早期纤维化过程;值得注意的是 F14与KRT5−/KRT17 AbBa细胞的相关性较强,并且F14在空间位置上与纤维化区域(Fibroblastic Foci,FF)一致。
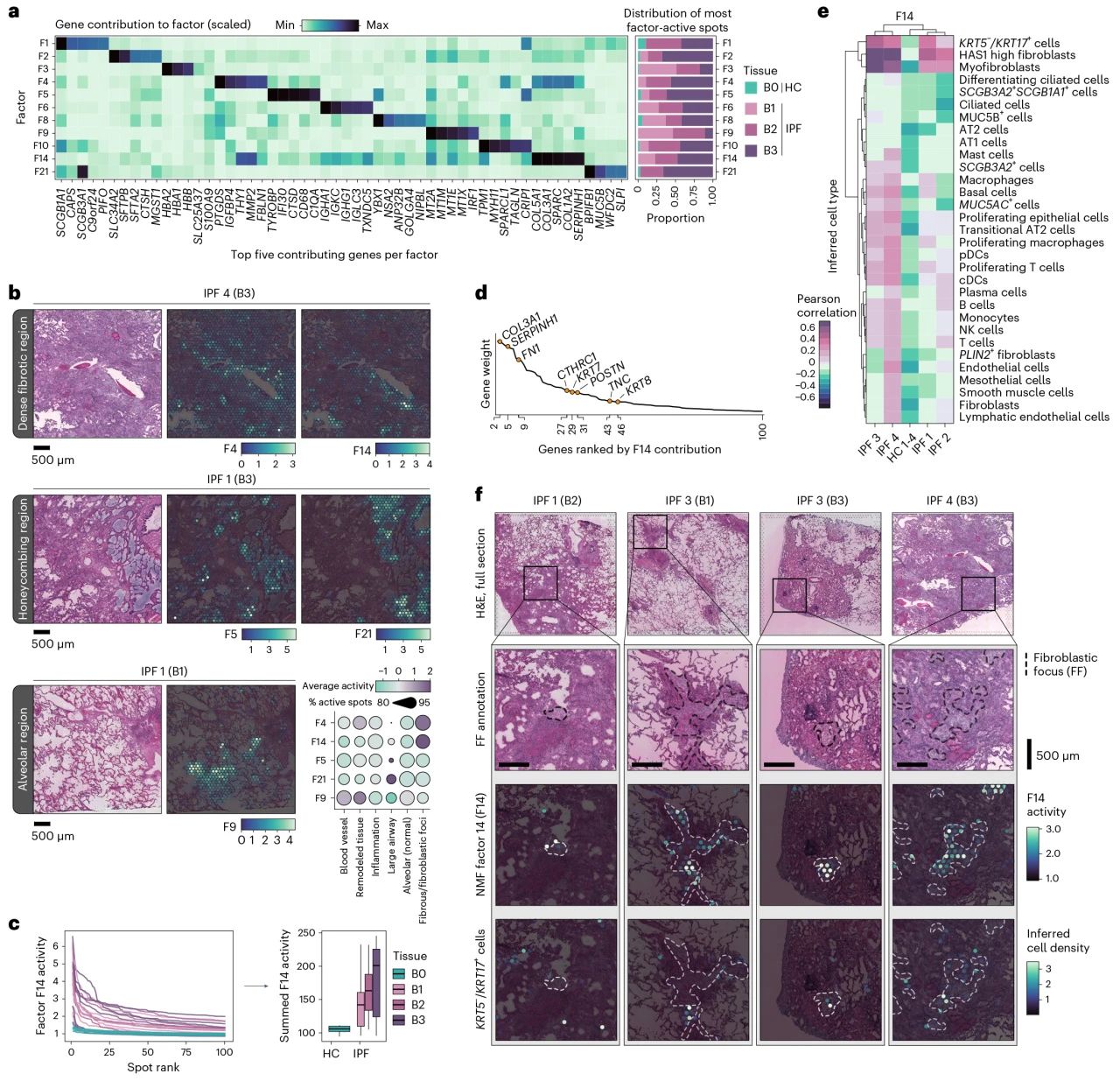
图2 NMF揭示疾病相关特征
1.2 IPF中AbBa生态位的特征
为了更好地了解 F14 中的细胞类型异质性,作者分离了其最活跃的位点(命名为F14hi)并确定了五个不同的亚簇,其中F14hi C0显著存在于四分之三的 IPF 供体中,并且在纤维化区域(FF)边缘显著富集,这与之前报道AbBa细胞定位外围的结果一致。
1.3 AbBa 微环境中的信号传导
F14hiC0 AbBa细胞周围的 AT2 细胞和活化 AT2 细胞的丰度更高,活化 AT2 细胞的密度峰值比 AT2 细胞稍靠近 AbBa,这表明可能存在从 AT2 细胞到活化的 AT2 细胞再到 AbBa 细胞的分化线。随后观察到基质重塑和纤维化相关基因(如MMP11、POSTN和COL1A2)会随着与 F14hiC0 的距离增加而减少,而与肺泡功能和免疫反应相关的基因(如SFTPA2、SFTPC和SLPI)在 C0 内的表达量低于周围细胞,这表明 AbBa 细胞周围的纤维化活动增强。并且F14hiC0簇表达多条与纤维化相关的信号通路,包括TGF-β、WNT和YAP/TAZ通路。进一步通过受配体分析确定了 F14hiC0 微环境中存在更多细胞间通讯,包括 TGFB1、IL1B 和 SFRP2以及脂蛋白信号。
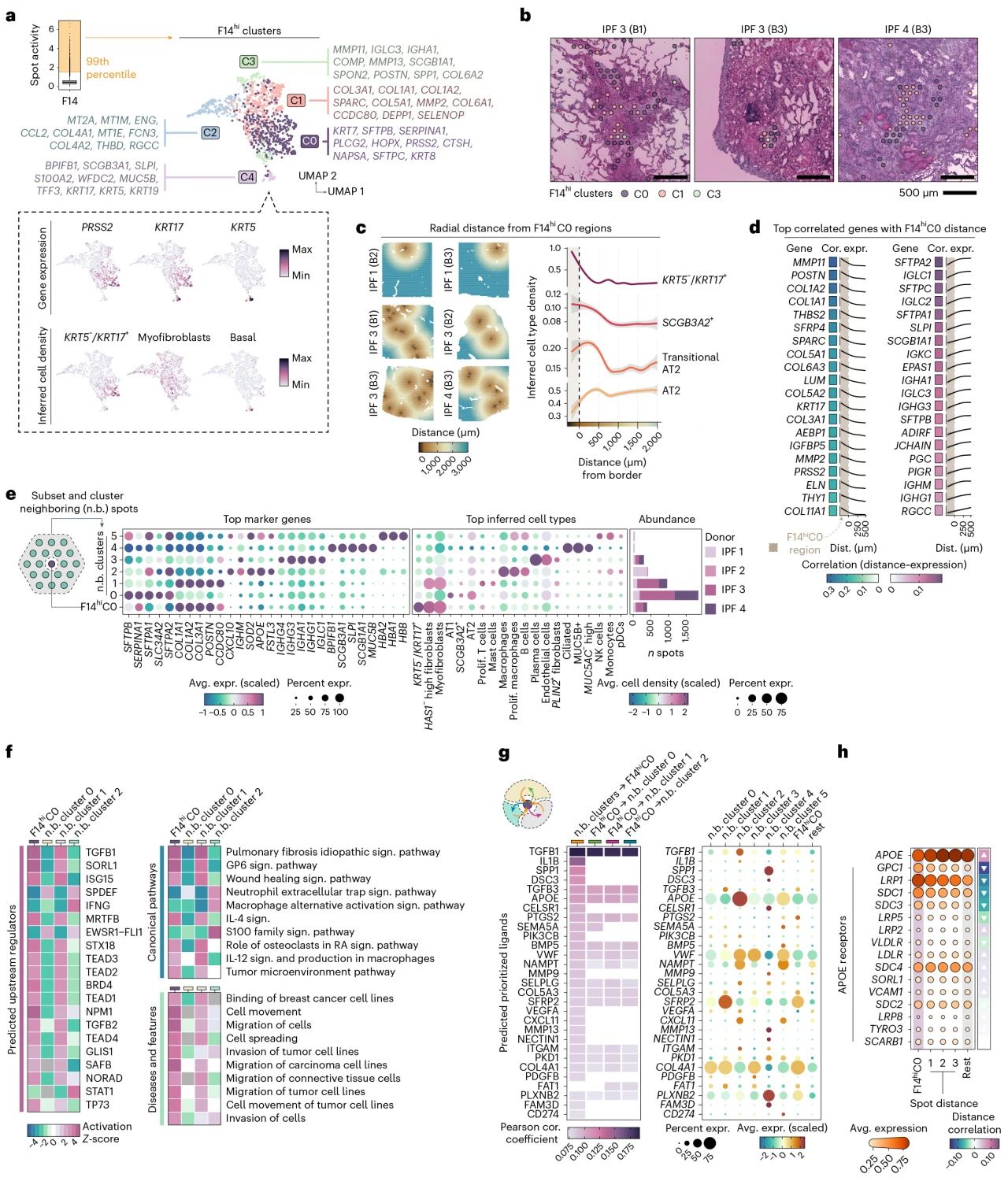
图3 AbBa生态位的细胞和分子反卷积
2. 肺纤维化小鼠模型中的空间转录组学
博来霉素诱导的BLM小鼠模型是肺纤维化最成熟的临床前模型,为了进一步分析小鼠模型和人类疾病的相关性,作者从单剂量BLM或生理盐水(载体)给药后第7天(d7)和第21天(d21)收集的小鼠肺样本中进行空间转录测序,生成BLM小鼠模型空间转录组图谱。
1)通过比较小鼠纤维化模型和人类IPF样本中的DEGs发现,有多达178个基因存在重叠,但其中有八个基因表达的相反,提示这些基因在两种模型中的功能可能不同;
2)结合单细胞转录组测序对小鼠肺纤维化样本进行细胞类型解卷积和空间可视化的分析,确定细胞类型空间位置分布;
3)鉴于小鼠模型中的d21反映了纤维化的既定阶段,急性炎症最小,专注于这个时间点进行人IPF和小鼠模型之间的比较分析。值得注意的KRT5−/KRT17 AbBa细胞(hsNMF-F14) 和小鼠Krt8 ADI细胞(mmNMF++d21-F14) 出现有限重叠。
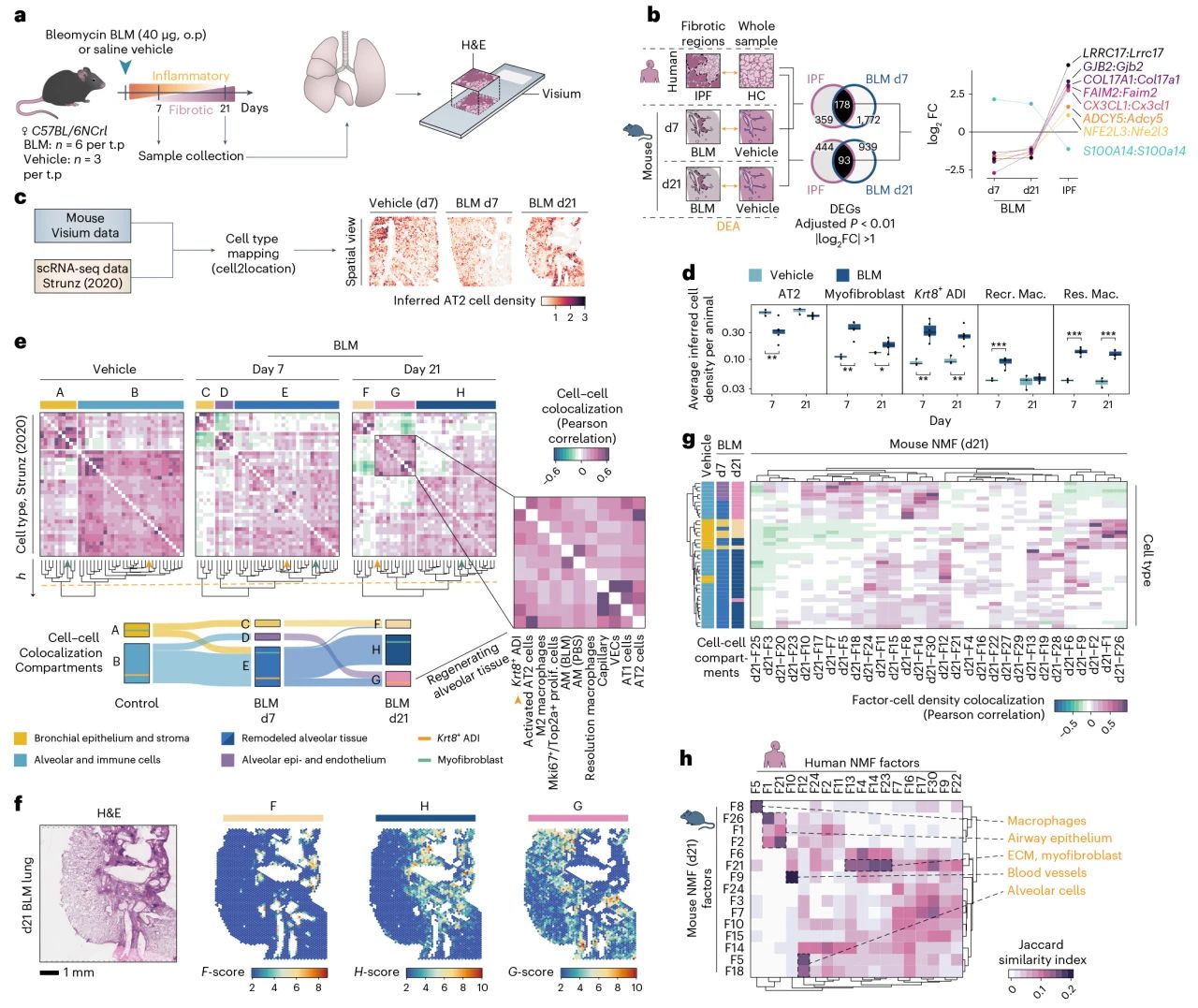
图4 小鼠和人类肺纤维化的比较分析
3. 纤维化免疫微环境
进一步对人类IPF的AbBa细胞(hsNMF-F14)和小鼠BLM模型中的ADI细胞(mmNMF++d21-F14)进行对比,ADI相关基因特征主要涉及与炎症和修复相关的通路,而AbBA特征以免疫反应和组织重塑的途径为主。作者发现了二者发育轨迹的明显区别,尽管两者似乎都是肺泡2型(AT2)细胞的起源,但小鼠是AT2是通过活化的AT2和ADI细胞分化为AT1细胞的单一途径,而人的AT2通过活化的AT2进一步分化为AbBa细胞或AT1细胞,肺泡再生被抑制导致持续加剧的纤维化。
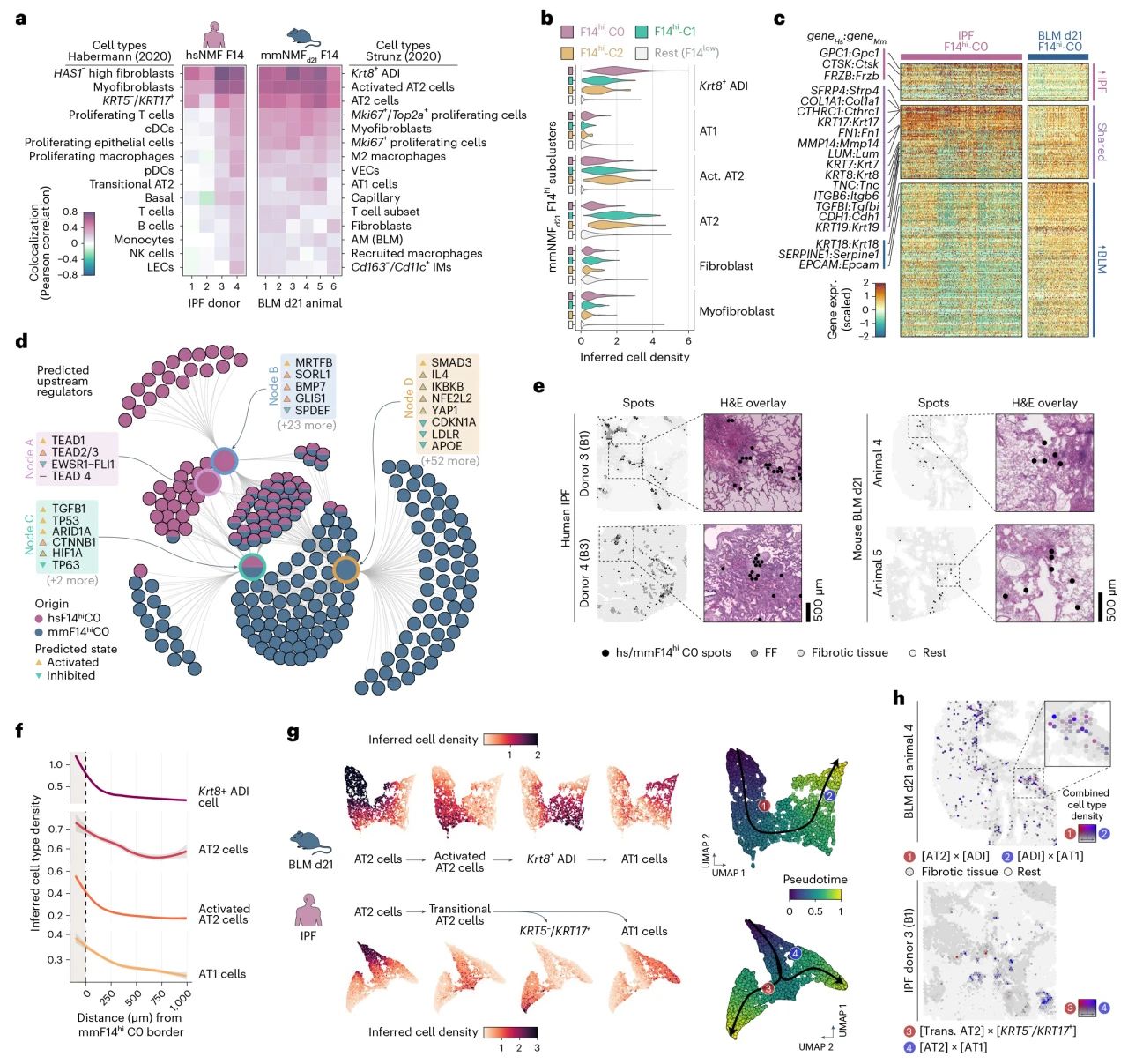
图5 纤维化生态位和细胞动力学的转化剖析
4. 肺纤维化中的免疫细胞动力学
NMF 分析揭示了 IPF 和 d7 /d21 BLM均表达巨噬细胞的关键基因,并且IPF和BLM在组织学上纤维化区域均显示免疫浸润,但发现IPF肺和BLM肺之间免疫密集区的基因表达和细胞类型组成存在显著差异。BLM区域显示出 B 细胞、T 细胞和树突状细胞相对均衡的表达,这与人类IPF 样本形成鲜明对比,在人类 IPF 样本中,CXCL13的明显表达表明免疫反应以 B 细胞为主。鉴于健康和患病肺部都存在淋巴细胞和浆细胞,推测淋巴细胞和浆细胞可能会调节纤维化的进展。
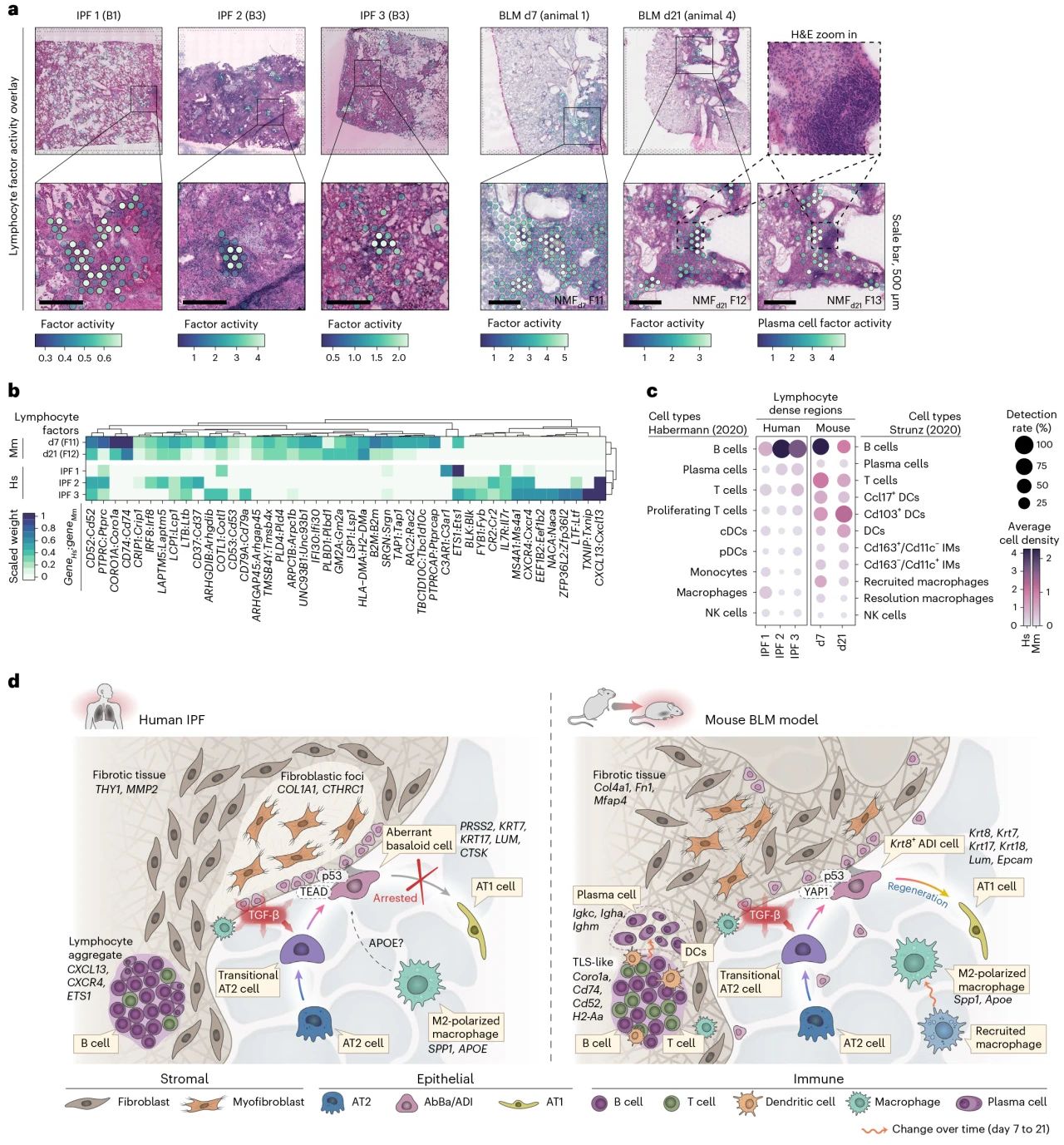
图6 IPF和BLM小鼠模型中纤维化生态位的免疫细胞特征和比较概述
总结
本文构建了人类IPF肺和BLM小鼠模型中比较全面空间转录组图谱,强调了人和小鼠模型中纤维化的差异,揭示了纤维化过程中关键的细胞类型和基因表达特征,加深对IPF病理学的理解并提供了丰富的数据集来进一步探索肺纤维化中复杂的细胞网络,为后续疾病机制的研究和动物模型在药物发现中的应用提供新见解。
参考文献
Franzén L, Olsson Lindvall M, Hühn M, et al. Mapping spatially resolved transcriptomes in human and mouse pulmonary fibrosis. Nat Genet. Published online July 1, 2024.
中科优品推荐
【中科新生命】时空团队潜心钻研,开发的空间多组学联合产品是全息的、数据真联合分析,打破湿实验和生信分析技术壁垒,助您实现超高分辨率、超大面积的空间多组学联合分析,真正做到一份样本,反馈多种空间组学数据,提供空间多组学一站式服务。