上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Immunity(IF 32.4)| 皮肤炎症的“连锁反应”:代谢如何驱动上皮-免疫共同失调模式
408 人阅读发布时间:2024-06-18 09:39
 炎症性上皮疾病,例如牛皮癣(PsO)、特应性皮炎(AD)和化脓性汗腺炎,会反映出炎性条件驱动免疫或细胞因子信号的修复的许多方面被放大,导致旺盛的表皮生长、血管增生、神经支配亢进和免疫激活,然而这种上皮-免疫共同失调模式以及他们之间的代谢层次结构目前还知之甚少。今年5月,纽约大学朗格尼健康中心团队在immunity杂志(IF 32.4)发表了题为Metabolic coordination between skin epithelium and type 17 immunity sustains chronic skin inflammation的研究文章,利用单细胞和空间转录组,并结合bulk转录组与其他检测技术,揭示了炎症性皮肤病中IL-17A-HIF1α信号轴的病理作用,并进一步揭示了炎症驱动的上皮糖酵解程序内在调节上皮行为并增强组织病理表现。
炎症性上皮疾病,例如牛皮癣(PsO)、特应性皮炎(AD)和化脓性汗腺炎,会反映出炎性条件驱动免疫或细胞因子信号的修复的许多方面被放大,导致旺盛的表皮生长、血管增生、神经支配亢进和免疫激活,然而这种上皮-免疫共同失调模式以及他们之间的代谢层次结构目前还知之甚少。今年5月,纽约大学朗格尼健康中心团队在immunity杂志(IF 32.4)发表了题为Metabolic coordination between skin epithelium and type 17 immunity sustains chronic skin inflammation的研究文章,利用单细胞和空间转录组,并结合bulk转录组与其他检测技术,揭示了炎症性皮肤病中IL-17A-HIF1α信号轴的病理作用,并进一步揭示了炎症驱动的上皮糖酵解程序内在调节上皮行为并增强组织病理表现。

研究材料
牛皮藓(PsO)患者活检组织、皮肤炎症小鼠模型、诱导皮肤类器官
技术方法
空间转录组、常规转录组
技术路线
步骤1:通过单细胞转录组、空间转录组公共数据确定人类炎症性皮肤病中HIF1α标志的异常上皮状态;
步骤2:PsO病理样本中17型免疫和表皮HIF1α存在共激活;
步骤3:表皮HIF1α缺失影响抗IL-17A或抗TNF-α治疗的响应;
步骤4:HIF1α的抑制调节PsO病变的代谢与表皮分化,具有比局部标准护理更强的效应;
步骤5:验证表皮HIF1α表达对产生炎症性皮肤病病理的必须性;
步骤6:上皮糖酵解过程促进上皮失调和更广泛的免疫病理;
步骤7:上皮糖酵解释放的乳酸引起17型炎症。
研究结果
1. HIF1α 标志着人类炎症性皮肤病中的异常上皮状态
作者首先对一组健康皮肤、PsO和AD皮肤的公开单细胞转录组数据进行分析,发现一个与分化相关的上皮细胞群体在PsO和AD皮肤中富集,并且特征差异基因富集到HIF1α信号通路和糖酵解/糖异生通路等。随后,在一组对健康对照、PsO病变和非病变皮肤样本的空间转录组公开数据集中发现在PsO病变皮肤中特异性富集炎性基底上皮细胞群体, IL-17信号通路、糖酵解/糖异生和HIF1α信号通路都在PsO特异性细胞群体中富集。
已有研究表明,HIFs在被缺氧或其他次要信号(如IL-17A)激活时,会转移到细胞核并发挥转录功能。免疫荧光显示,在各类炎症性病变如PsO、化脓性皮损等中,HIF1α与DAPI重叠,表明该因子在人类炎症性皮肤病中被激活。
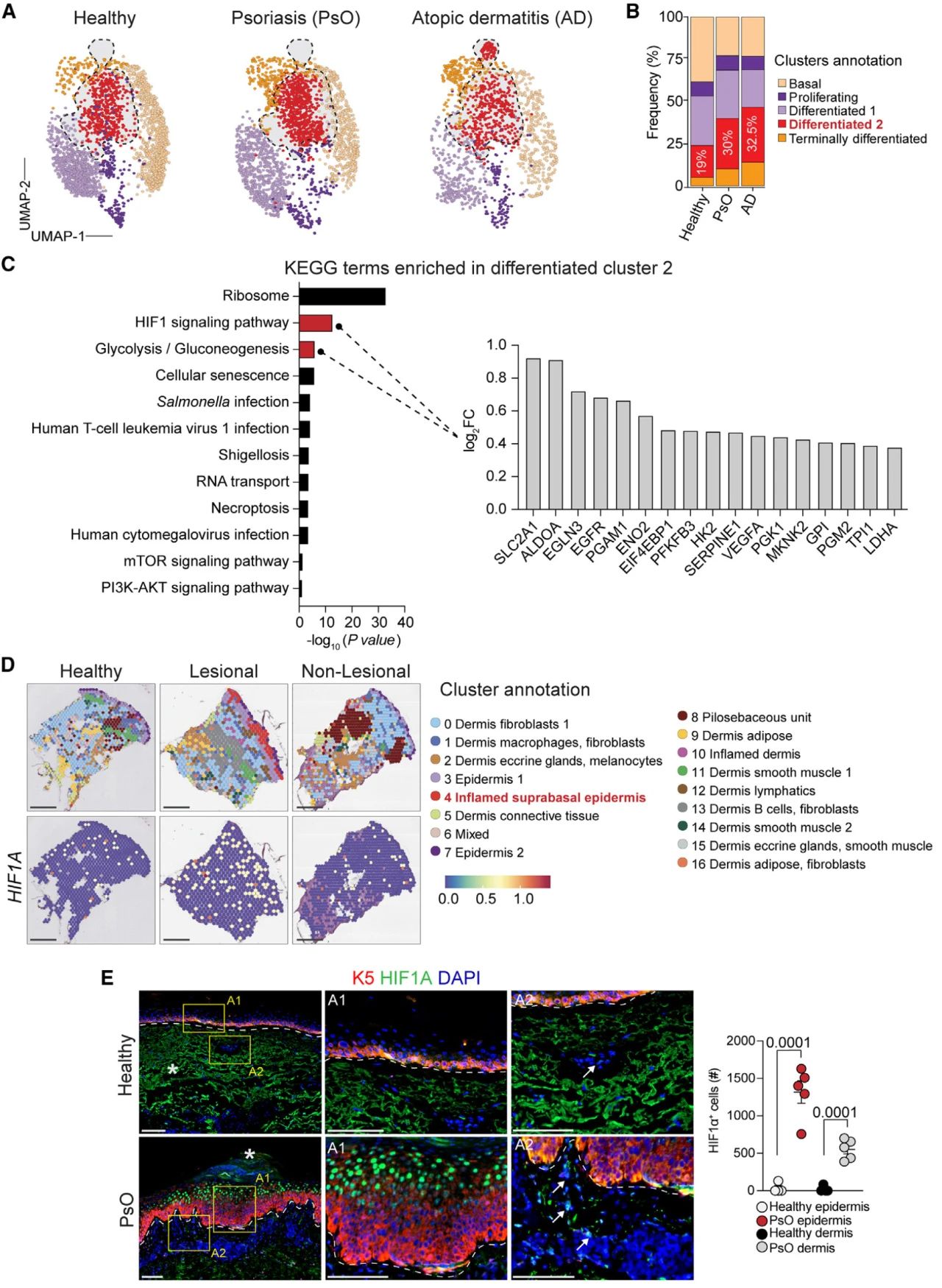 图1 HIF1α在人类炎症性皮肤病中界定了一种功能异常的上皮状态
2. PsO中17型免疫和表皮HIF1α的共激活
已知17型免疫在驱动银屑病病理中具有重要作用,且作者发现HIF1α是IL-17A信号传导的效应者,因此,在PsO患者的匹配病变和非病变样本中进行免疫荧光分析,分析显示CD3+T细胞活性与表皮病理(KRT5层厚度)和HIF1α激活(核表达)之间存在联系。为进一步探索HIF1α激活与IL-17A免疫驱动的唯1性,作者评估了HIF1α激活与IL-17RC (IL-17A的常见受体)表达的相关性,观察到PsO病变具有HIF1α和IL-17RC的共表达。
图1 HIF1α在人类炎症性皮肤病中界定了一种功能异常的上皮状态
2. PsO中17型免疫和表皮HIF1α的共激活
已知17型免疫在驱动银屑病病理中具有重要作用,且作者发现HIF1α是IL-17A信号传导的效应者,因此,在PsO患者的匹配病变和非病变样本中进行免疫荧光分析,分析显示CD3+T细胞活性与表皮病理(KRT5层厚度)和HIF1α激活(核表达)之间存在联系。为进一步探索HIF1α激活与IL-17A免疫驱动的唯1性,作者评估了HIF1α激活与IL-17RC (IL-17A的常见受体)表达的相关性,观察到PsO病变具有HIF1α和IL-17RC的共表达。
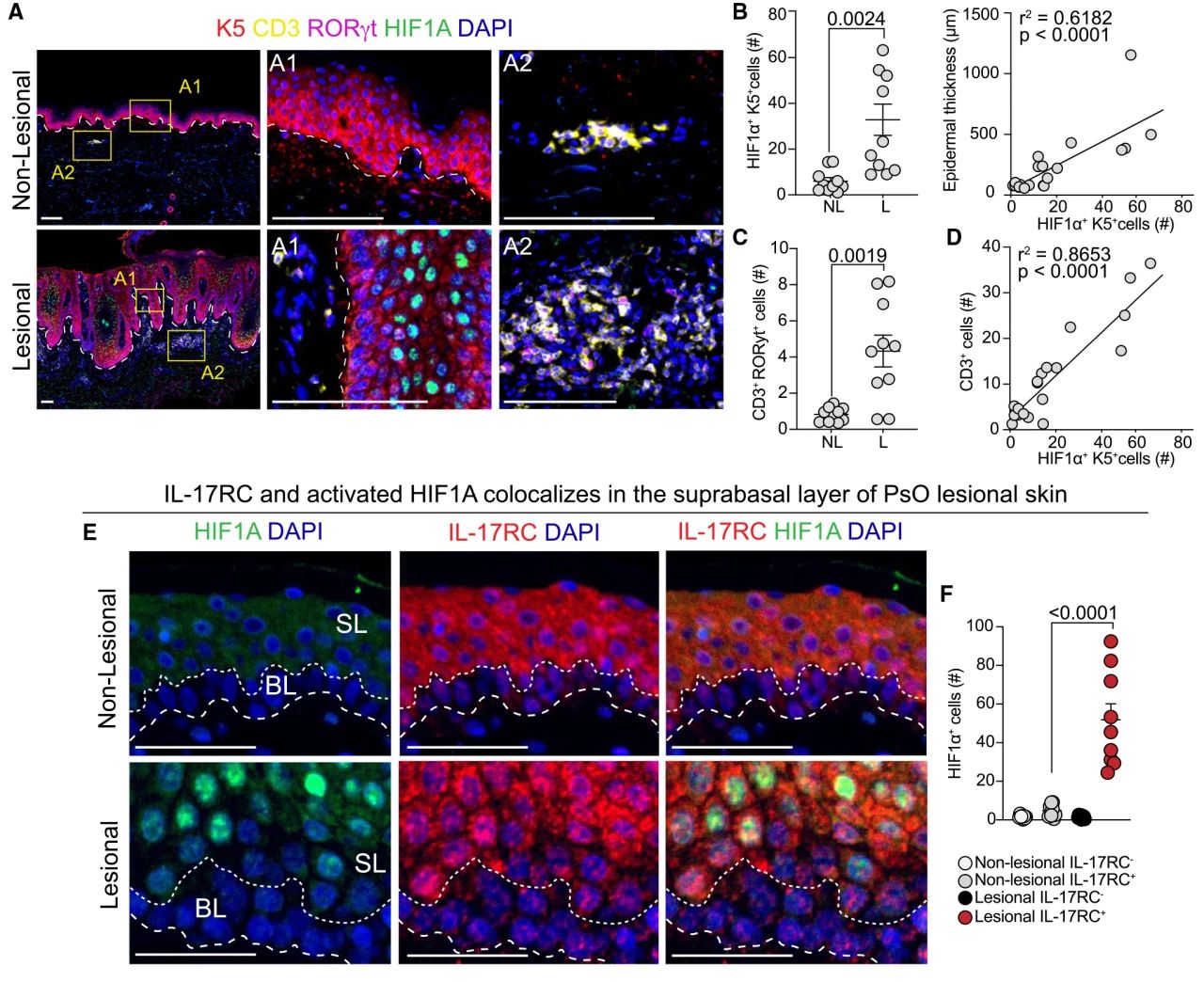 图2 PsO病变中17型免疫和表皮HIF1α的共同激活
3. 抗IL-17A或抗TNF-α治疗响应与表皮HIF1α缺失相关
目前,临床IL-17A阻断疗法通常在治疗6个月内实现患者皮肤斑块的完全缓解,作者关注成功治疗后HIF1α水平是否正常化,故对一名接受抗IL-17A治疗获得了完全的临床缓解的PsO患者进行了治疗前和治疗后的活检,进行了空间转录组分析,观察到基底表皮集群在治疗前的皮肤中富集。此外,作者发现PsO病变中HIF1A、IL17RA和IL17RC含量丰富,且在治疗后在消退皮肤中的表达与非病变皮肤相当。随后作者在接受抗TNF-α治疗达到缓解的10例患者队列中测量了HIF1α蛋白表达,表皮HIF1A表达也同样降低。这些结果都表明,在成功的生物治疗后,旺盛的IL-17A信号传导和相关的HIF1α表达得到了解决。
图2 PsO病变中17型免疫和表皮HIF1α的共同激活
3. 抗IL-17A或抗TNF-α治疗响应与表皮HIF1α缺失相关
目前,临床IL-17A阻断疗法通常在治疗6个月内实现患者皮肤斑块的完全缓解,作者关注成功治疗后HIF1α水平是否正常化,故对一名接受抗IL-17A治疗获得了完全的临床缓解的PsO患者进行了治疗前和治疗后的活检,进行了空间转录组分析,观察到基底表皮集群在治疗前的皮肤中富集。此外,作者发现PsO病变中HIF1A、IL17RA和IL17RC含量丰富,且在治疗后在消退皮肤中的表达与非病变皮肤相当。随后作者在接受抗TNF-α治疗达到缓解的10例患者队列中测量了HIF1α蛋白表达,表皮HIF1A表达也同样降低。这些结果都表明,在成功的生物治疗后,旺盛的IL-17A信号传导和相关的HIF1α表达得到了解决。
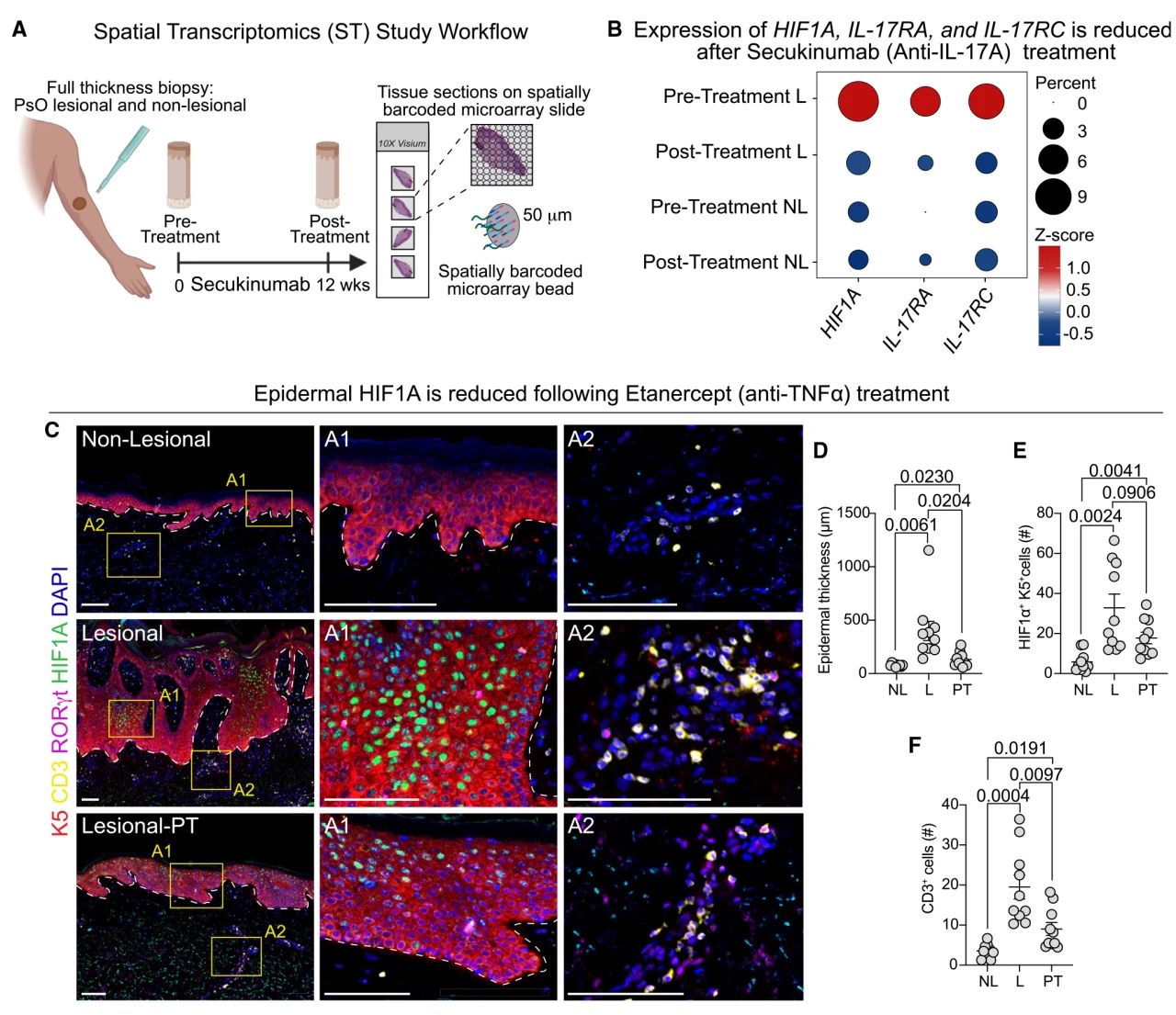 图3 上皮HIF1α的表达在PsO患者响应治疗后趋于正常
4. HIF1α的抑制调节PsO病变的代谢与表皮分化,具有比局部标准护理更强的效应
在生物治疗响应患者中表皮HIF1α的显著缺失提示我们,这种因子可能是皮肤病的关键协调者。因此,作者对5例生物治疗无响应的PsO患者活检切片在体外进行培养后,分别使用载体对照、HIF1α抑制剂或局部标准护理(SoC、钙化三烯和二丙suan倍他米松)培养24小时,并以其他非炎症性病变的手术皮肤用作健康对照并接受相同的治疗方案。随后对这些样本都进行了bulk转录组学分析,发现 PsO病变皮肤中,HIF1α抑制造成2698个基因显著差异表达,而SoC仅造成147个。其中,与糖酵解代谢相关基因(ENO2、PGK、GPI和PFKB4)、STAT3激活(KDM3A和ANGPTL4)和上皮发育/分化(KRT31、KRT34、CASP14和KLK5)的表达下调。
再随即,作者对接受安慰剂(9名患者)或抗IL-17A阻断治疗(24名患者)的基因表达进行了纵向分析,预测HIF1α抑制的调节基因。观察到HIF1α抑制后表达上调的基因无法区分s患者是否响应治疗。相比之下,下调的基因表达特征则能够将抗IL-17A治疗组与安慰剂区分开来。
图3 上皮HIF1α的表达在PsO患者响应治疗后趋于正常
4. HIF1α的抑制调节PsO病变的代谢与表皮分化,具有比局部标准护理更强的效应
在生物治疗响应患者中表皮HIF1α的显著缺失提示我们,这种因子可能是皮肤病的关键协调者。因此,作者对5例生物治疗无响应的PsO患者活检切片在体外进行培养后,分别使用载体对照、HIF1α抑制剂或局部标准护理(SoC、钙化三烯和二丙suan倍他米松)培养24小时,并以其他非炎症性病变的手术皮肤用作健康对照并接受相同的治疗方案。随后对这些样本都进行了bulk转录组学分析,发现 PsO病变皮肤中,HIF1α抑制造成2698个基因显著差异表达,而SoC仅造成147个。其中,与糖酵解代谢相关基因(ENO2、PGK、GPI和PFKB4)、STAT3激活(KDM3A和ANGPTL4)和上皮发育/分化(KRT31、KRT34、CASP14和KLK5)的表达下调。
再随即,作者对接受安慰剂(9名患者)或抗IL-17A阻断治疗(24名患者)的基因表达进行了纵向分析,预测HIF1α抑制的调节基因。观察到HIF1α抑制后表达上调的基因无法区分s患者是否响应治疗。相比之下,下调的基因表达特征则能够将抗IL-17A治疗组与安慰剂区分开来。
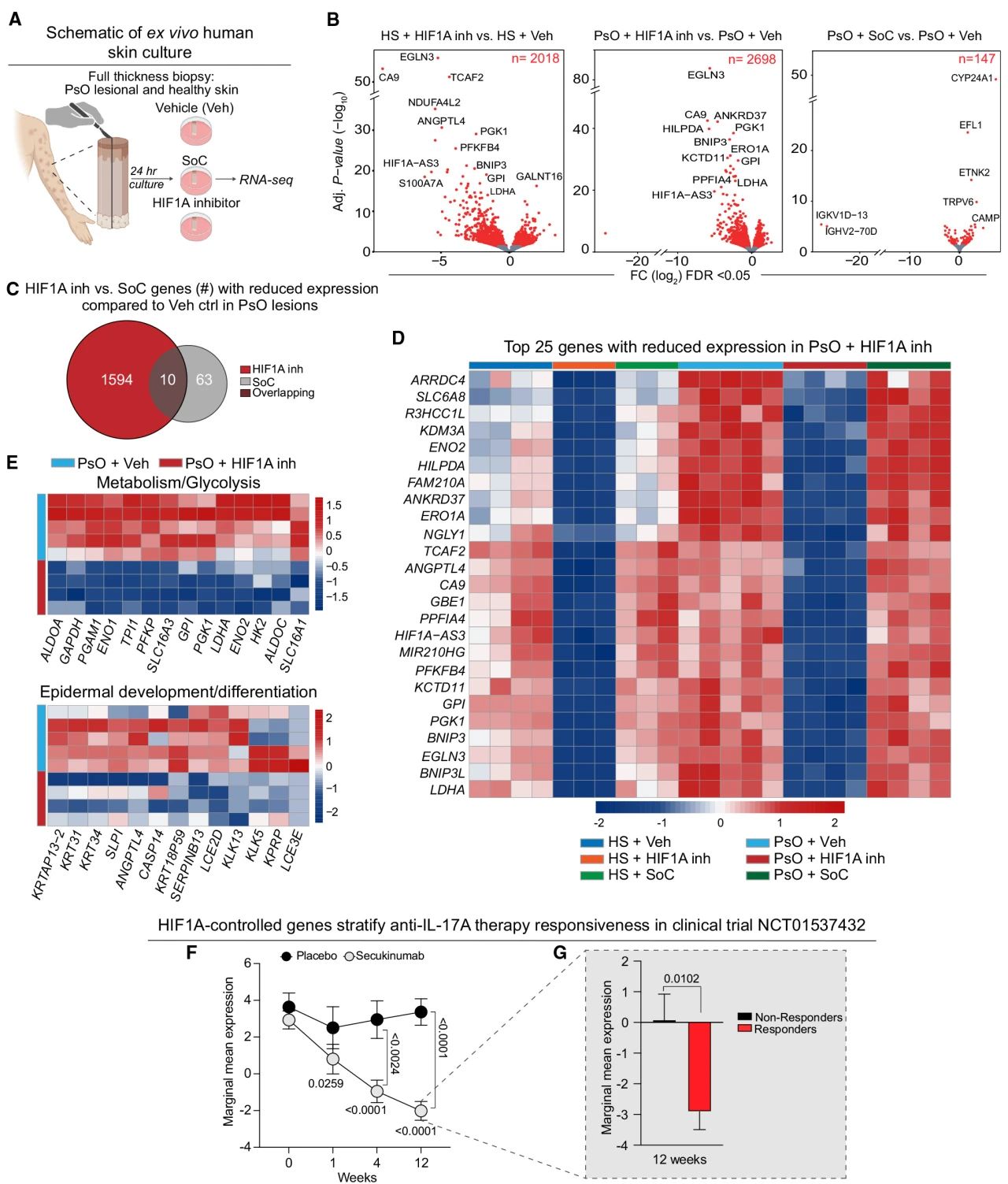 图4 人PsO病变皮肤中的代谢和表皮分化基因受到体外HIF1α抑制的影响
图4 人PsO病变皮肤中的代谢和表皮分化基因受到体外HIF1α抑制的影响
5. 在小鼠模型中,表皮HIF1α表达是产生银屑病病理所必需的 为了探索表皮特异性HIF1α激活在驱动疾病中的因果作用,作者构建了一个由TLR-7激动剂IMQ诱导的银屑病样炎症小鼠模型。重要的是,IMQ处理在病理开始时诱导HIF1α表达,在疾病高峰期(第6天)信号显著增强。接下来,作者发现IMQ处理诱导皮肤表现出缺氧微环境,然而,HIF1α表达并不仅限于缺氧区域。因此,作者选择探究IL-17A信号是否在PsO中是HIF1α的关键触发因素。实验表明, IL-17RC缺失的小鼠,特别是表皮特异性缺失,会使得HIF1α表达显著降低,并且免受IMQ诱导的病理影响。 随后,作者验证了局部抑制HIF1α可以保护小鼠免受IMQ诱导的体内炎症病理。在没有炎症的情况下,使用HIF1a激活剂局部提高表皮HIF1α表达水平不足以增强病理表现。对上皮特异性的HIF1α缺陷小鼠给药IMQ和IL - 23诱导的PsO模型中也均证实了在没有炎症信号的情况下,HIF1α的缺失不会改变表皮特征。另外,HIF1α siRNA处理后,小鼠在IMQ处理后皮肤病理明显减少。这些数据支持了表皮HIF1α是介导旺盛IL-17A信号传导作用的关键节点,并在病理上延续炎症反应的观点。
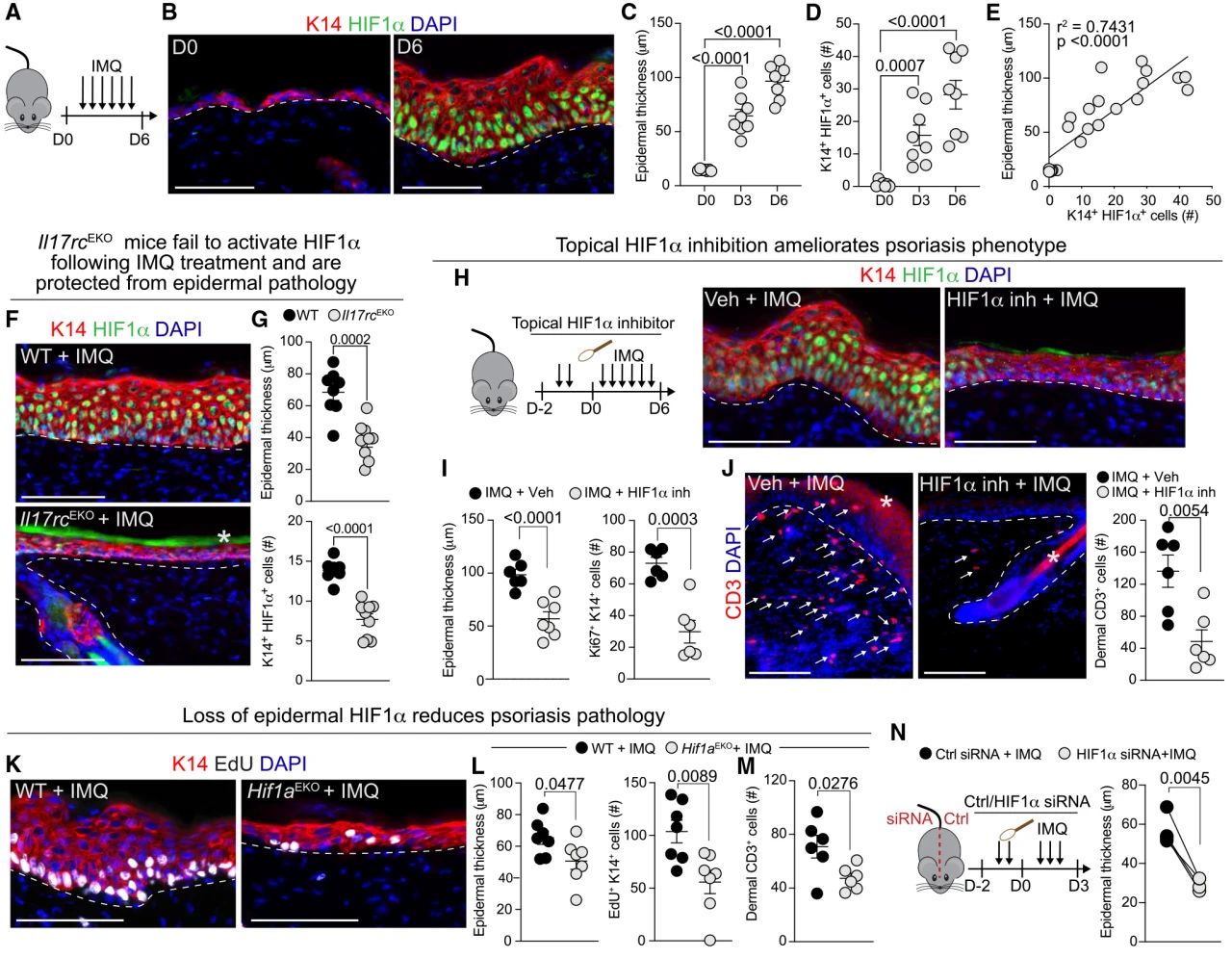 图5 表皮HIF1α表达是小鼠PsO多系统病理所必需的
6. 上皮糖酵解是促进上皮失调和更广泛的免疫病理所必需的
为了更深入地研究分子机制,作者对IMQ处理后Hif1aEKO和野生型(WT)皮肤组织进行了bulk RNA-seq。观察到与糖酵解、线粒体功能、表皮分化和免疫相关的转录本表达下调。作为验证,作者检测了两个关键代谢相关靶基因Glut1(基因名称Slc2a1 )和NDUFA4L2(泛素酶的一个亚基)的蛋白表达。Hif1aEKO小鼠的Glut1和NDUFA4L2的表达显著降低。作者还在IL-17A刺激后,检测了仅由小鼠皮肤上皮细胞组成的初级类器官的炎症反应,并发现与表皮功能障碍和代谢相关的基因表达上调。这些发现表明,HIF1α介导的表皮内在代谢重编程是PsO病变的关键。
为了评估糖酵解的作用,作者构建了表皮特异性glut1缺陷小鼠(Slc2a1EKO)。这类小鼠,完全不受IMQ处理影响。限制上皮细胞摄取葡萄糖的能力,从而进行糖酵解,也显著地抑制了银屑病病理典型的血管增生和神经支配过度。Slc2a1EKO小鼠的皮肤CD3+T细胞数量也显著低于WT对照组,γδT17细胞比例和IL-17A的产生量也显著降低。
图5 表皮HIF1α表达是小鼠PsO多系统病理所必需的
6. 上皮糖酵解是促进上皮失调和更广泛的免疫病理所必需的
为了更深入地研究分子机制,作者对IMQ处理后Hif1aEKO和野生型(WT)皮肤组织进行了bulk RNA-seq。观察到与糖酵解、线粒体功能、表皮分化和免疫相关的转录本表达下调。作为验证,作者检测了两个关键代谢相关靶基因Glut1(基因名称Slc2a1 )和NDUFA4L2(泛素酶的一个亚基)的蛋白表达。Hif1aEKO小鼠的Glut1和NDUFA4L2的表达显著降低。作者还在IL-17A刺激后,检测了仅由小鼠皮肤上皮细胞组成的初级类器官的炎症反应,并发现与表皮功能障碍和代谢相关的基因表达上调。这些发现表明,HIF1α介导的表皮内在代谢重编程是PsO病变的关键。
为了评估糖酵解的作用,作者构建了表皮特异性glut1缺陷小鼠(Slc2a1EKO)。这类小鼠,完全不受IMQ处理影响。限制上皮细胞摄取葡萄糖的能力,从而进行糖酵解,也显著地抑制了银屑病病理典型的血管增生和神经支配过度。Slc2a1EKO小鼠的皮肤CD3+T细胞数量也显著低于WT对照组,γδT17细胞比例和IL-17A的产生量也显著降低。
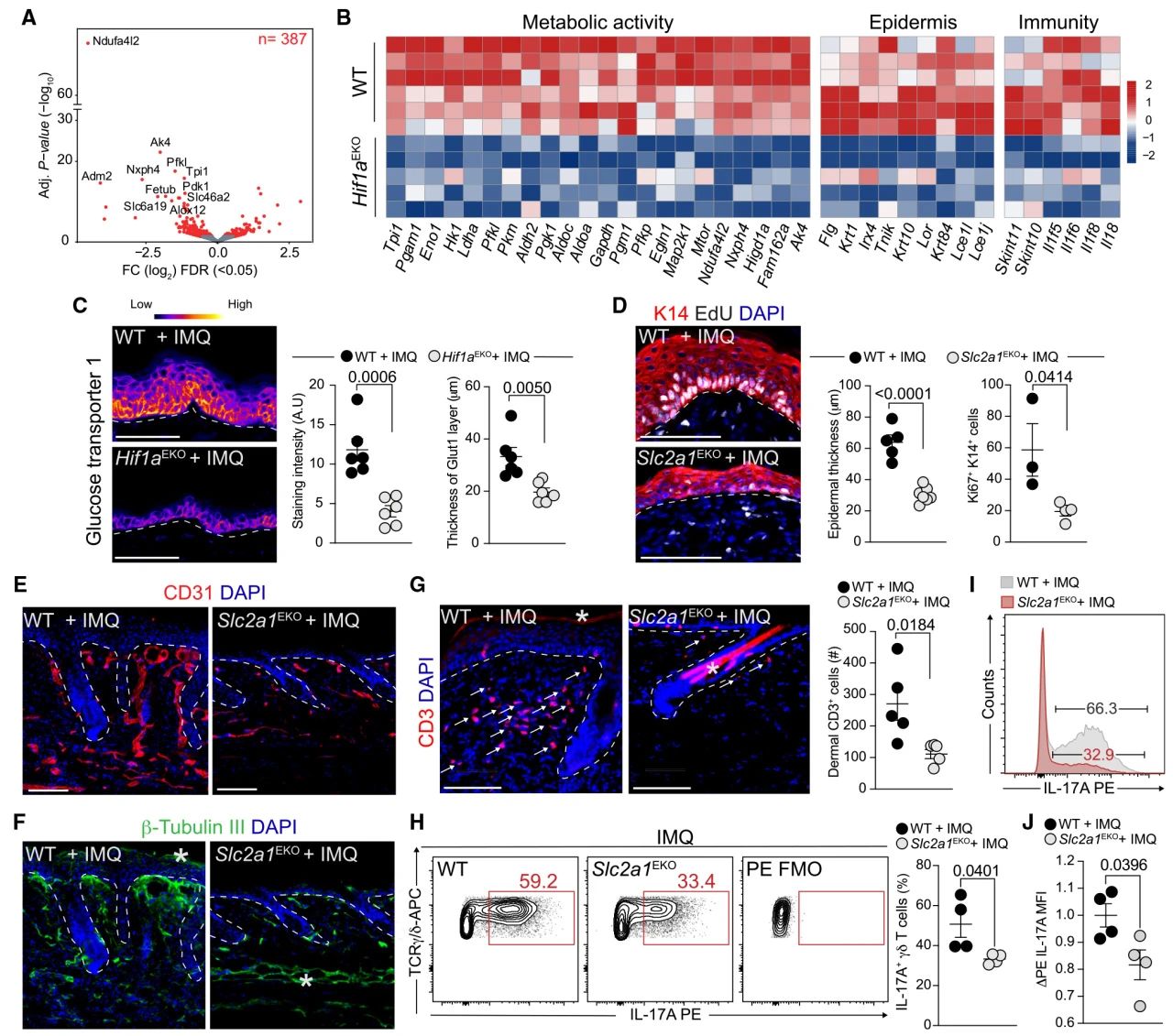 图6 上皮糖酵解促进PsO病理并维持17型免疫反应
7. 上皮糖酵解释放的乳酸引起17型炎症
与典型的HIFs靶点(Vegfa和Slc2a1)相比,IMQ处理后,在Hif1aEKO和WT皮肤之间,γδT17细胞相关的细胞因子Ccl20、Il1a、Il1b、Il6和Il23a转录本的表达没有显著差异。因此,作者判断是代谢物而非基因表达介导表皮HIF1α诱导的糖酵解的病理作用。在IL-17A处理的类器官培养基中可以检测到乳酸——糖酵解过程最丰富的代谢物。此外,HIF1α抑制人PsO后,乳酸转运体SLC16A1 (MCT1)和SLC16A3 (MCT4)的表达均下调,但SoC没有。IMQ处理的Slc2a1EKO离体培养物的乳酸产生显著减少,表明乳酸的产生在很大程度上是由上皮特异性糖酵解驱动的。
对小鼠模型抑制乳酸生成或运输能够限制上皮厚度和皮肤T细胞数量。IMQ处理后,抑制剂处理小鼠皮肤引流淋巴结中的γδT17细胞显著减少。在含有CD3和CD28的低糖培养基中对γδ-T细胞进行培养,导致IL-17A释放显著增加,表明γδT17细胞吸收乳酸增加了IL-17A的产生。缺失Rorc启动子小鼠会抑制乳酸代谢过程。IMQ处理后的LdhaRorcCre表皮厚度和真皮CD3+细胞减少,皮肤Il17a表达减少,皮肤引流淋巴结中的γδT17细胞显著减少。这些发现表明,由高度糖酵解上皮提供的乳酸可以增强潜在的17型反应,特别是IL-17A,从而增强皮肤疾病炎症的前馈循环。
图6 上皮糖酵解促进PsO病理并维持17型免疫反应
7. 上皮糖酵解释放的乳酸引起17型炎症
与典型的HIFs靶点(Vegfa和Slc2a1)相比,IMQ处理后,在Hif1aEKO和WT皮肤之间,γδT17细胞相关的细胞因子Ccl20、Il1a、Il1b、Il6和Il23a转录本的表达没有显著差异。因此,作者判断是代谢物而非基因表达介导表皮HIF1α诱导的糖酵解的病理作用。在IL-17A处理的类器官培养基中可以检测到乳酸——糖酵解过程最丰富的代谢物。此外,HIF1α抑制人PsO后,乳酸转运体SLC16A1 (MCT1)和SLC16A3 (MCT4)的表达均下调,但SoC没有。IMQ处理的Slc2a1EKO离体培养物的乳酸产生显著减少,表明乳酸的产生在很大程度上是由上皮特异性糖酵解驱动的。
对小鼠模型抑制乳酸生成或运输能够限制上皮厚度和皮肤T细胞数量。IMQ处理后,抑制剂处理小鼠皮肤引流淋巴结中的γδT17细胞显著减少。在含有CD3和CD28的低糖培养基中对γδ-T细胞进行培养,导致IL-17A释放显著增加,表明γδT17细胞吸收乳酸增加了IL-17A的产生。缺失Rorc启动子小鼠会抑制乳酸代谢过程。IMQ处理后的LdhaRorcCre表皮厚度和真皮CD3+细胞减少,皮肤Il17a表达减少,皮肤引流淋巴结中的γδT17细胞显著减少。这些发现表明,由高度糖酵解上皮提供的乳酸可以增强潜在的17型反应,特别是IL-17A,从而增强皮肤疾病炎症的前馈循环。
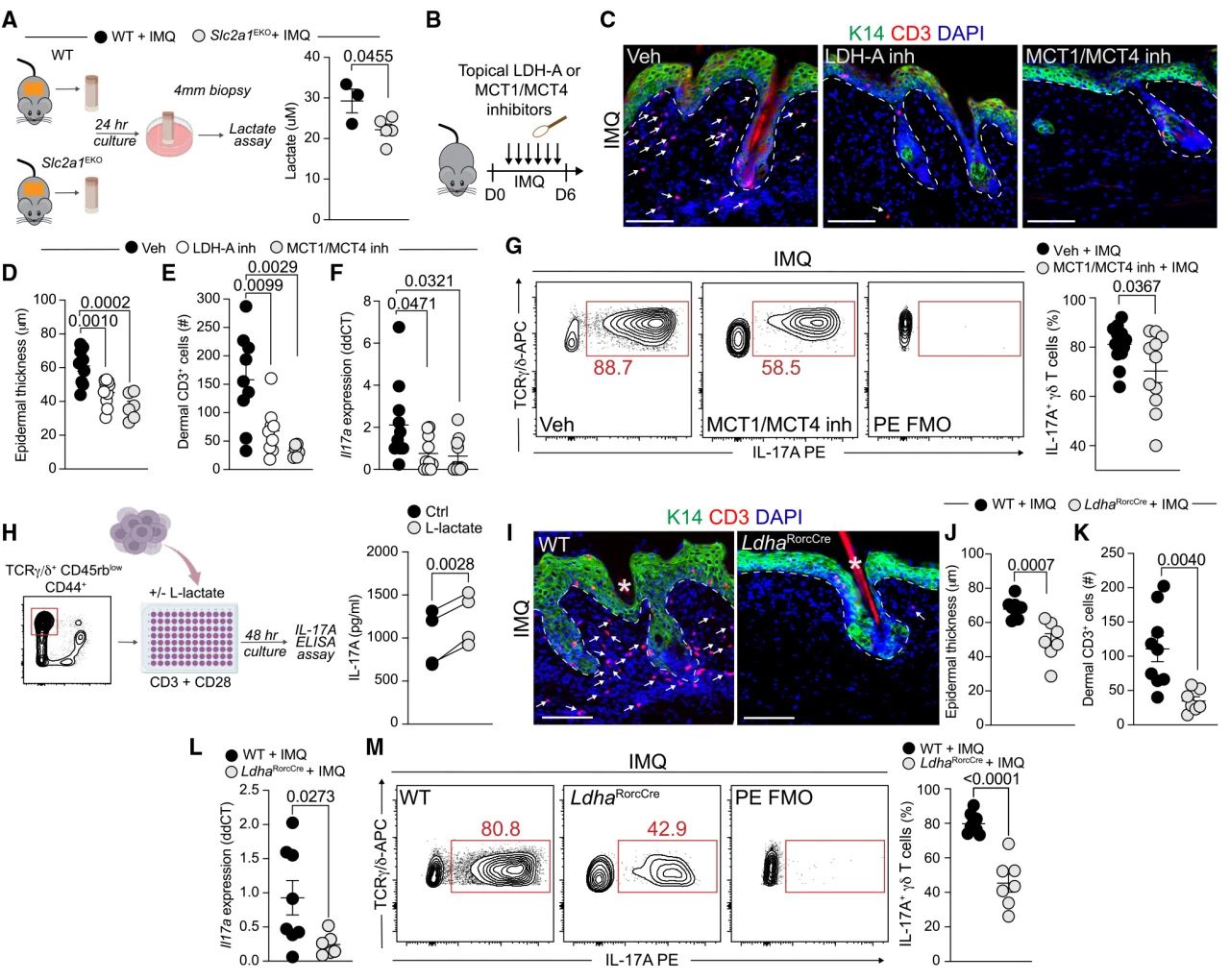 图7 乳酸促进γδT17细胞介导的炎症
图7 乳酸促进γδT17细胞介导的炎症
小编小结
越来越多的空间分辨率的研究表明,淋巴细胞在各种各样的组织微区和应激条件下产生关键作用,因此,要想深入了解健康和疾病中的免疫,就必须了解局部代谢过程中的微环境变化与免疫功能的关联。在这篇文章中,作者通过时空组学技术强调了PsO中IL-17A-HIF1α信号轴的作用机制,介导上皮源性乳酸增强T17炎症,为炎性疾病中免疫细胞和上皮细胞之间的病理串扰提供了深入的见解。对于如何从疾病的微环境中细胞频率的变化着手锁定研究关注点,本文也提供了一个很好的思路范本。
中科优品推荐
【中科新生命】钜惠来袭!单细胞和空间组学联合产品大促,可提供完整的空间多组学联合研究 “一站式”解决方案,全面助力各位老师勇攀科研高峰! 优惠多多,诚意满满,快来联系我们吧!