上海中科新生命生物科技有限公司
18 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Nat Genet(IF 30.8)| 单细胞联合空间多组学揭示未治疗和耐药胰腺癌微环境中细胞亚群的协同作用
916 人阅读发布时间:2024-03-13 09:43
由于起病隐匿发现晚,早期转移和放化疗治疗抗性,胰腺导管腺癌(PDAC)的五年生存率仅有 11%,治疗仍是手术,然后是放疗/化疗,免疫治疗选择有限。单细胞分辨率下已知NK、CD8+T数量和功能上受损导致出现免疫抑制性的肿瘤微环境,但内在机制尚未清晰。随着腺泡-导管化生(ADM)的研究越来越多,发现当腺泡细胞开始表达KRAS(G12D)时,动物模型将腺泡细胞作为 PDAC 的起源,但在单细胞分辨率下对于腺泡和 ADM 细胞较低的捕获效,使得上述假设在人类样本中依然难以进行评估确认。
近期,来自美国密苏里州圣路易斯市圣路易斯华盛顿大学的研究人员在Nature Genetics(IF 30.8)发表了题为“Spatially restricted driversand transitional cell populations cooperate withthe microenvironmentin untreated and chemo-resistant pancreaticcancer”的文章。该研究通过使用单细胞/核转录组(Sc/SnRNA-seq)、空间转录组学和细胞成像技术,以及包括Bulk RNA-seq、WES、蛋白组、磷酸化修饰组在内的多组学技术,研究来自31例PDAC患者的83个样本,揭示了胰腺癌发生的两个关键过渡点(即从正常细胞到癌变前细胞的转变,以及从癌变前细胞向胰腺癌细胞的转变)的细节信息,并阐释了癌细胞对疗法耐受性的分子机制,以及如何利用特殊的免疫疗法来治疗恶性肿瘤类型。

实验材料
31名患者中收集了83份PDAC样本
结果概述
结果1:样本采集策略及队列详情概述;
结果2:单细胞转录组联合空间转录组识别不同功能的PDAC肿瘤细胞亚群;
结果3:PDAC中的KRAS信号和空间信号的驱动因素;
结果4:腺泡、导管及肿瘤发生过程的过渡细胞群体;
结果5:利用snRNA-seq、免疫荧光和验证ADM的发生;
结果6:基于空间转录组学研究过渡群体的组织学特征;
结果7:PDAC 肿瘤微环境中的CAF亚群的功能与分子特征;
结果8:PDAC免疫抑制的肿瘤微环境特征和治疗。
1. 样本采集策略及队列概述
作者从接受过标准治疗的21名患者中收集了73份PDAC样本,包括4份正常和邻近组织样本,并对每个肿瘤进行2-4次空间采样用以生成组织学、影像学和组学数据,实验包括HE染色、单细胞RNA测序(SnRNA-seq)、蛋白质组、磷酸化修饰组、全外显子测序(WES)、bulk-RNA-seq等。同时作者也另外收集了10个病例生成了具有匹配空间转录组学、RNA-seq 和 WES 数据的 snRNA-seq组学数据。
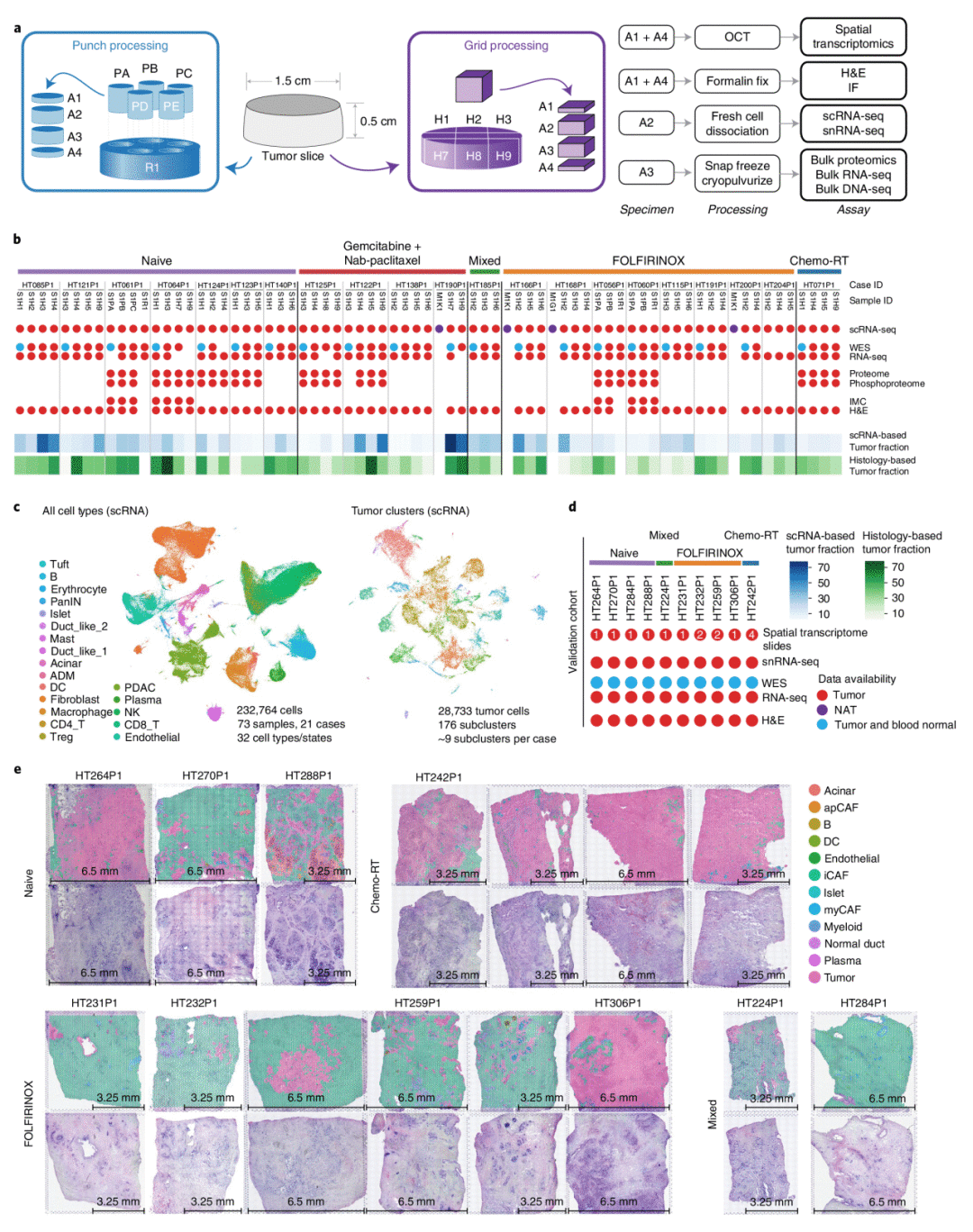
图1 样本采集策略及队列概述
2. 单细胞转录组联合空间转录组识别具有不同功能的PDAC肿瘤细胞亚群
单细胞转录组结果显示,在73个样本中共识别到了176个肿瘤细胞亚群,通过对亚群之间的信号通路富集分析解析了肿瘤异质性,鉴定了包括细胞增殖、细胞应激反应、上皮-间充质转化和免疫相关信号在内的特异性肿瘤细胞亚群。作者进一步将单细胞转录组的数据结果通过反卷积的形式与空间转录组进行了联合分析,并结合HE染色整合组织学特征来表征空间异质性,发现在同一患者样本中的肿瘤细胞亚群具有截然不同的转录程序以及空间表达模式。
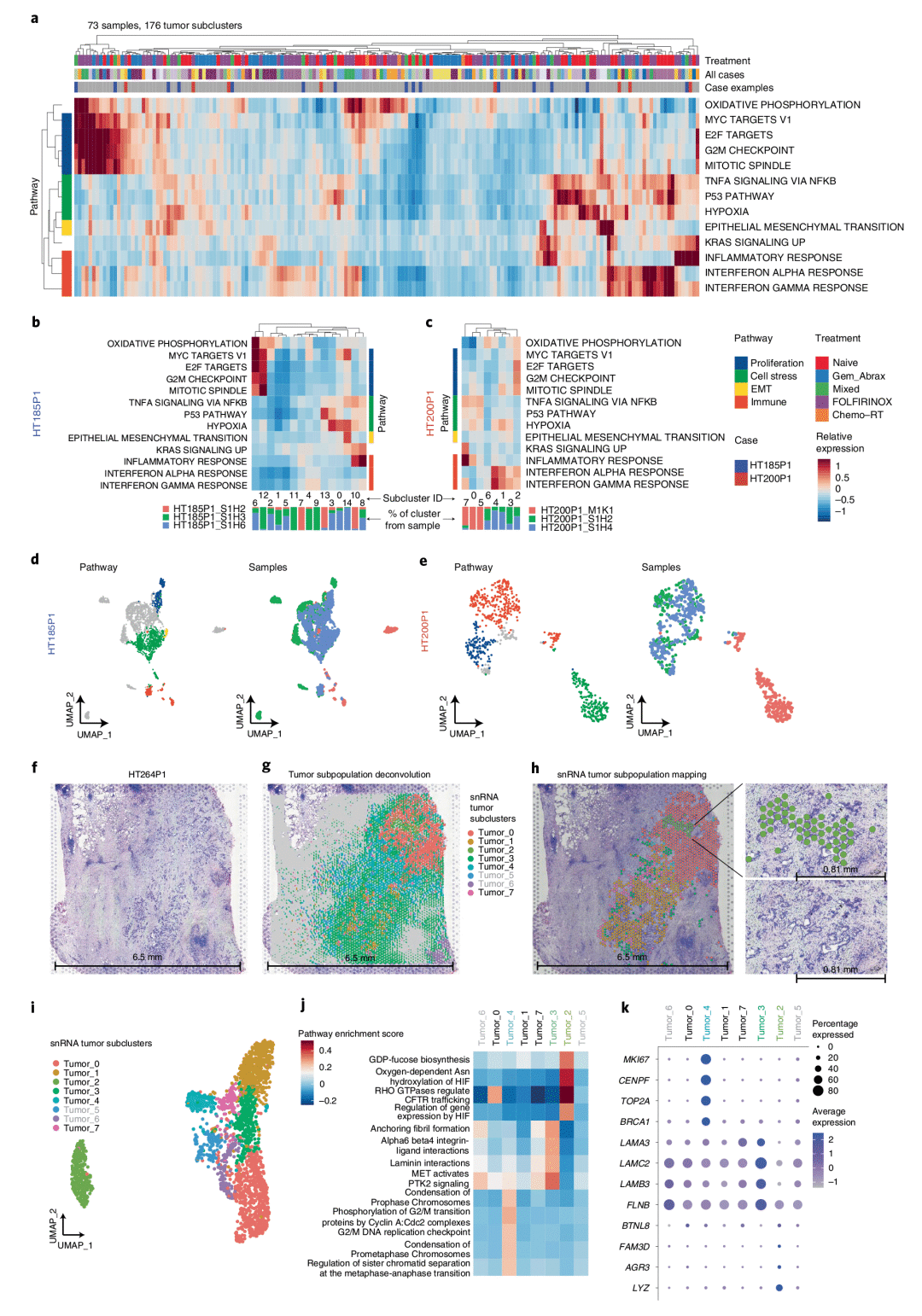
图2 具有独特细胞功能的肿瘤细胞亚群
3. PDAC中的KRAS信号和空间信号的驱动因素
为了观察到样本之间驱动突变变异等位基因分数(VAF)的显著差异,作者将突变和拷贝数改变映射到单个细胞,通过比较具有给定KRAS突变的每个肿瘤细胞亚群的基因表达谱来测试KRAS热点变体的影响,确定了五个具有多个KRAS热点驱动因素的病例。利用inferCNV分析,作者识别了HT061P1病例中各自KRAS亚克隆特有的拷贝数变异(CNV)特征,并利用WES进一步评估拷贝数变化,并提出了一个整合基因表达和CNV数据的模型。为了评估蛋白质组异质性,对来自9例肿瘤患者的30个样本进行了全局成对相关分析。通过分析几种致癌途径中蛋白质和磷酸化水平的相关变化,研究人员确定了突变对下游靶点的影响。研究人员发现,在PI3K/PDk1/Akt和Raf/Mek/Erk通路内的几个磷酸化蛋白在肿瘤之间和肿瘤内部存在差异性调节模式。
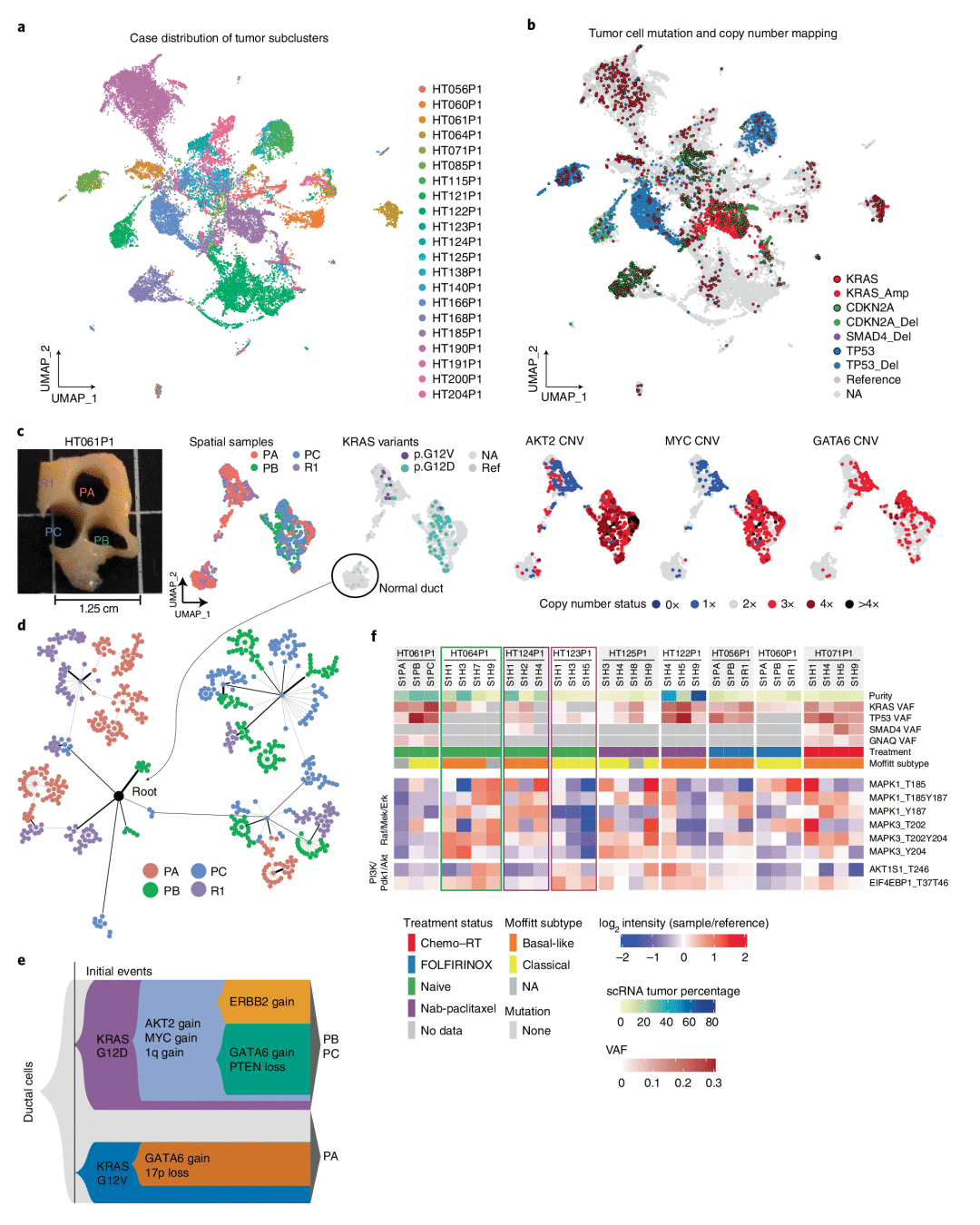
图3 PDAC中的KRAS信号和空间信号的驱动因素
4. 腺泡、导管及肿瘤发生过程的过渡细胞群体
PDAC产生于经历过ADM的腺泡细胞的假设已经在小鼠中进行了验证,但没有在人类中验证。一个主要障碍是以单细胞分辨率从患者身上采集的腺泡和ADM细胞数量较少。作者为了验证人PDAC 来自经历 ADM 的腺泡细胞的假设,从多个样本中鉴定出表达腺泡标记物(PRSS1、CELA3A)的腺泡细胞群。Acinar-REG+ 亚群表现出高表达的再生蛋白被认为可促进 PDAC 中的 ADM 和 PanIN;Duct-like1 亚群表达应激细胞marker,并具有来自胰腺导管生态位的祖细胞样特征;Duct-like2 亚群细胞被定义为恶性 PDAC 细胞的主要来源,并且在转录上类似于健康胰腺中鉴定的细胞;PanIN 亚群表现出细胞外基质相关基因(DCN、SPARC、SPON1)、多种胶原蛋白、涉及腺泡到导管重编程的基因(KLF4、MMP7)和其他早期恶性肿瘤标志物的表达(CXCL12、TIMP3、ITGA1、MUC5AC)。细胞分群结果中位于腺泡细胞和正常导管谱系之间的亚群被定义为ADM-Normal,位于腺泡和 PanIN 之间的亚群被定义为ADM-Tumor,提示中间的可逆状态。最后通过拟时序发育估计分析发现两种不同的过渡状态:
1. ADM-Normal,存在于腺泡细胞向正常导管细胞路径过渡的过程中;
2. ADM-Tumor,存在于腺泡细胞过渡到PanIN的过程中。
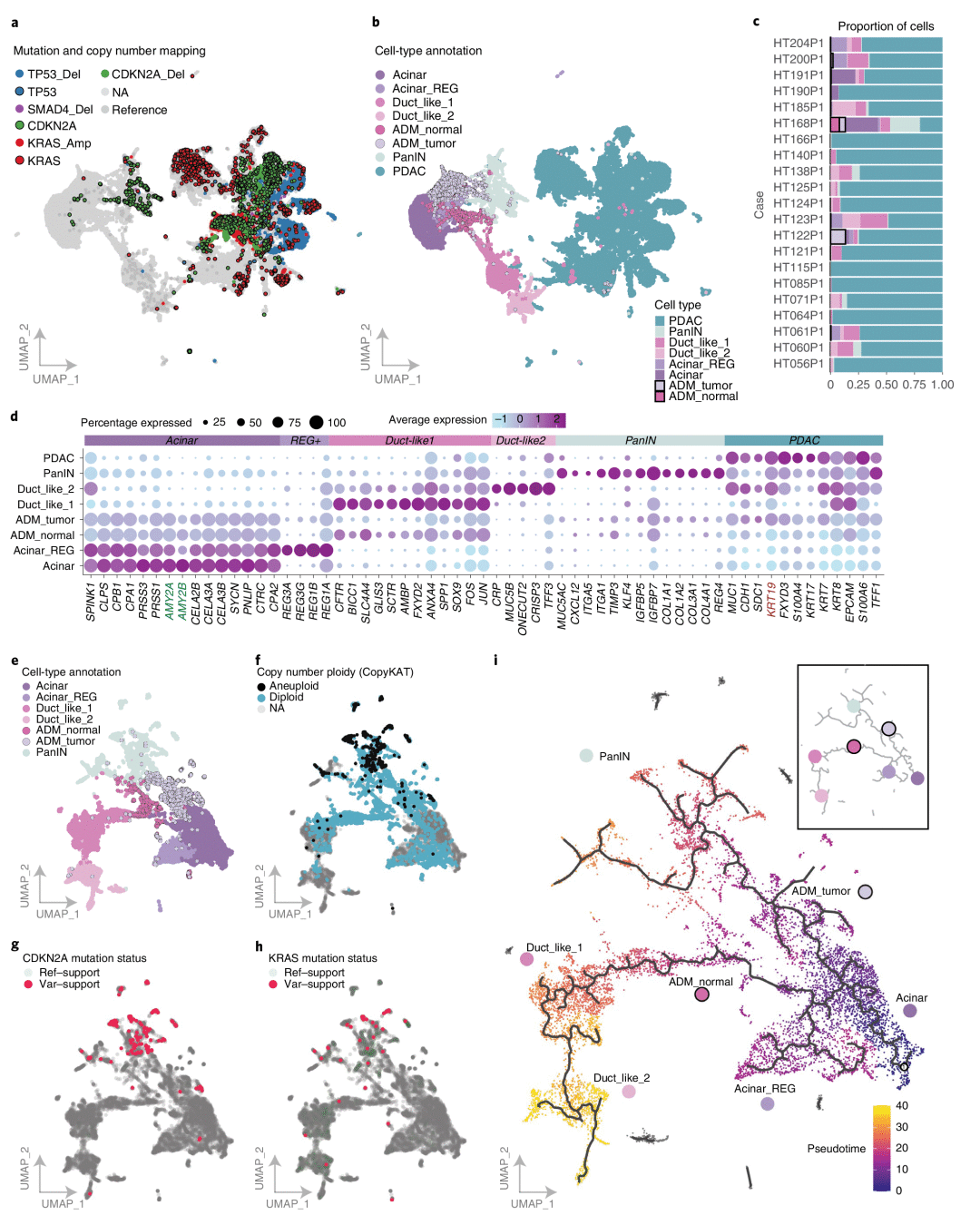
图4 腺泡、导管及肿瘤发生过程的过渡细胞群体
5. 利用snRNA-seq、免疫荧光和验证ADM的发生
研究人员通过snRNA-seq对两个样本进行了正交试验,以确定是否可以从冷冻组织中识别出表达腺泡和导管特征,并且用免疫荧光染色进行了验证,观察到多个肿瘤区域的多个单细胞内腺泡和导管标志物的共同染色。之后研究团队对来自小鼠模型的,包括诱导胰腺炎、KRAS驱动的早期和晚期转化(KPC-OG-GEMM小鼠)和正常胰腺组织进行了scRNA-seq分析,数据也进一步证实了上述关于ADM发生的结果,并且这些结果能够将腺泡起源的PDAC模型扩展到人类的临床事件中。
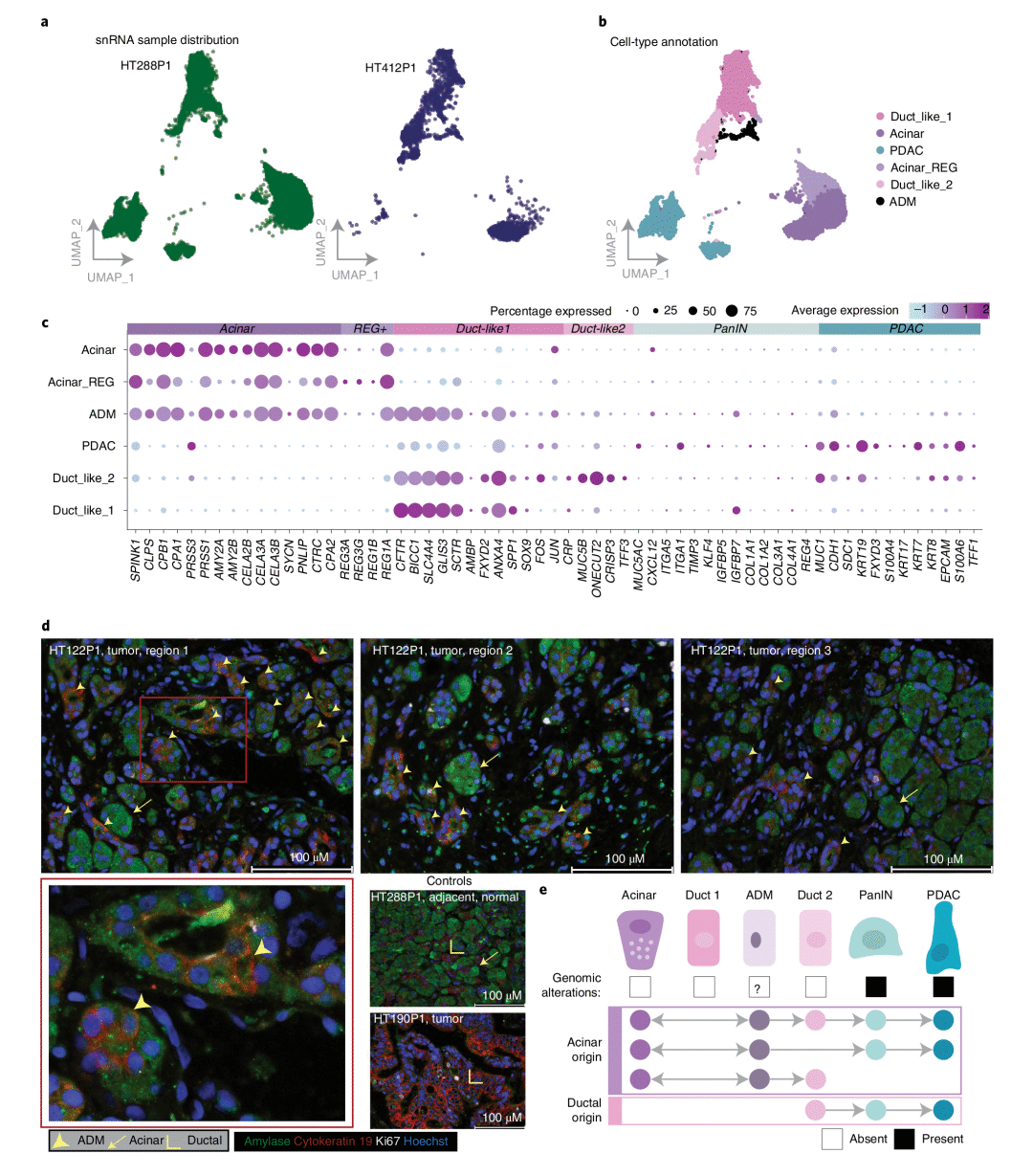
图5 利用snRNA-seq、免疫荧光和验证ADM的发生
6. 基于空间转录组学研究过渡群体的组织学特征
空间转录组学能够识别组织学特征,这与单细胞转录组是非常好的相互补充。通过单细胞转录组联合空间转录组分析,可以获得空间转录层面上每个捕获位点的细胞类型解析(RCTD)。作者将病理学注释的空间转录组学数据、HE 染色图像以及RCTD进行比较,观察到肿瘤、正常导管和腺泡细胞的病理学定义区域和分子区域之间存在很强的一致性。目前在空间转录组学数据中验证 ADM 仍然很困难,因为空间转录组学技术尚未达到真正的单细胞分辨率,而且 ADM 细胞也较为少见。作者用 PanIN 和捕获区域内的导管结构注释了选定样本中的空间转录组学点,然后从完整对象中对提取的点进行子集化,并分析差异表达基因(DEG),结果显示孤立的 PanIN 区域表现出跨越多个样本的不同 DEG。
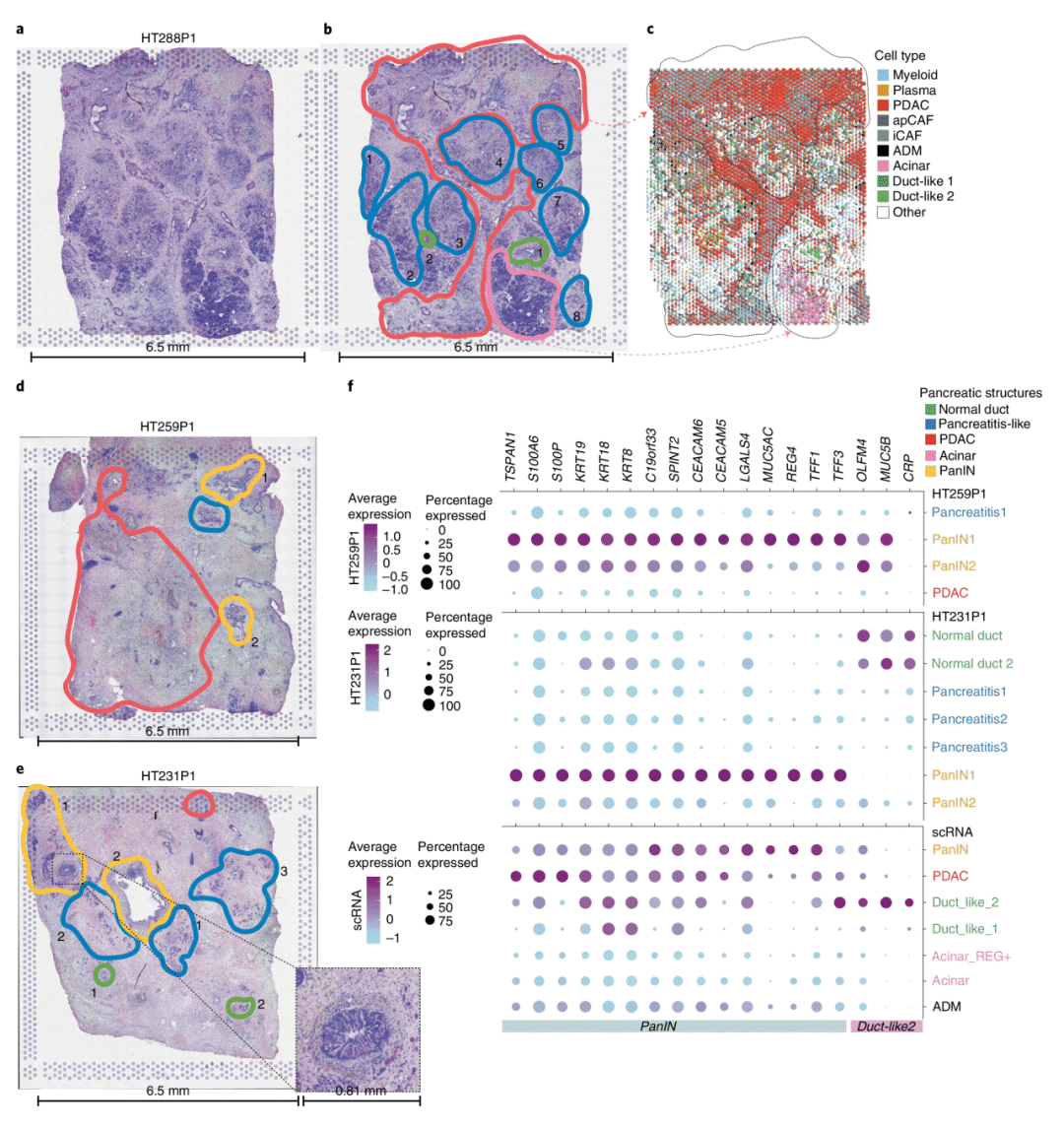
图6 基于空间转录组学研究过渡群体的组织学特征
7. PDAC 肿瘤微环境中的CAF亚群的功能与分子特征
整合单细胞转录组的数据结果,研究人员鉴定出了三类CAF亚型:肌纤维母细胞CAF(MYCAF)、炎性CAF(ICAF)和抗原呈递CAF(APCAF)。通过估计不同治疗组的细胞类型富集,研究人员发现包括内皮细胞和肿瘤细胞在内的适度变化,此外在成纤维细胞内不同亚群展现出了与治疗相关的较大差异性变化,并且经治疗的肿瘤具有更高水平的ICAF,这是化疗耐药肿瘤的潜在靶点。之后研究人员也通过蛋白组的数据的差异分析,发现差异丰富的蛋白质中的一些可能来自TME。
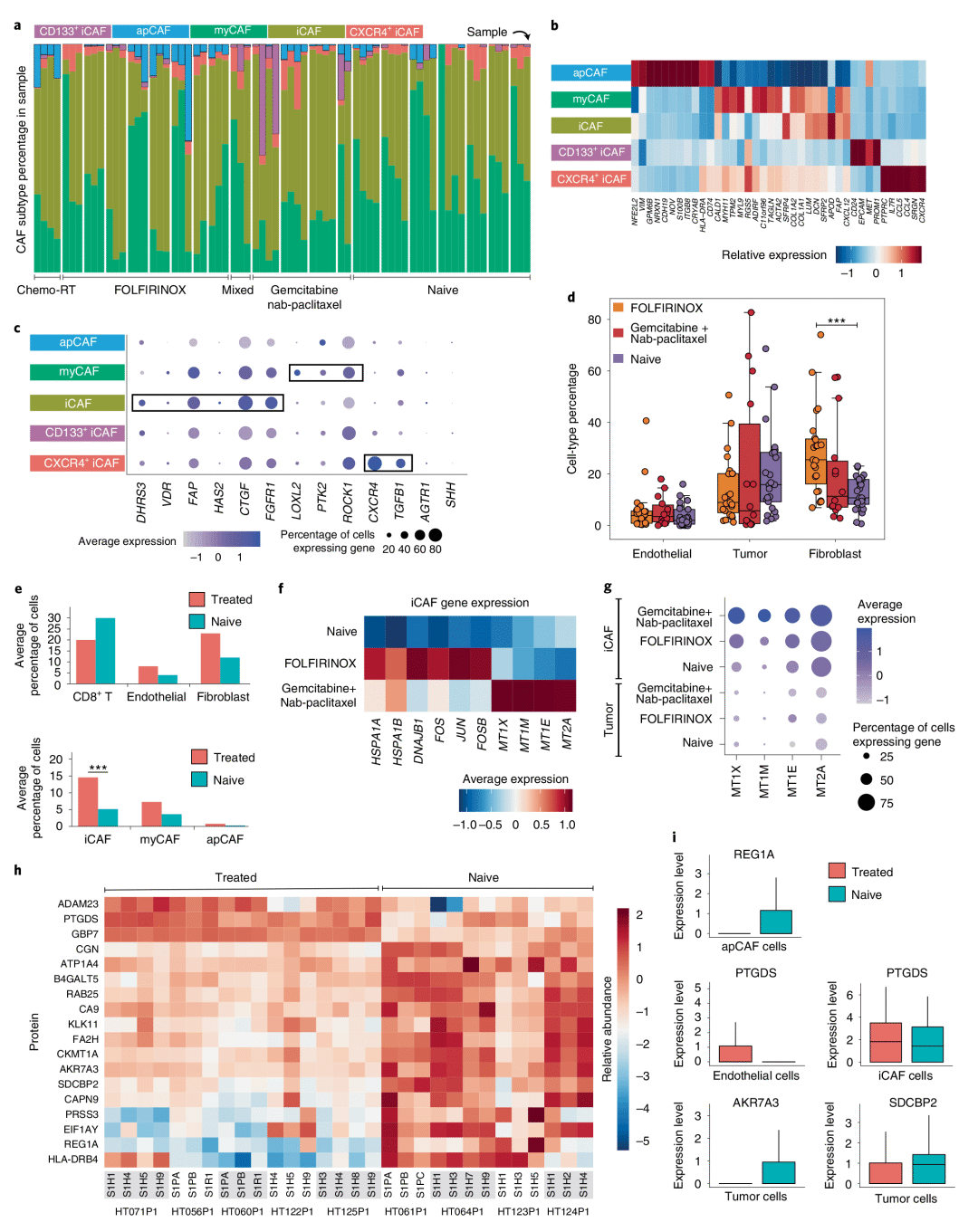
图7 PDAC 肿瘤微环境中的CAF亚群
8. PDAC免疫抑制的肿瘤微环境特征和治疗
这里,研究团队分析了PDAC的免疫抑制TME特征,结果表明髓系细胞和树突状细胞有助于促肿瘤TME重塑。通过受配体分析与空间转录组数据整合,展示了TIGIT在耗竭和调节性T细胞中的高表达,而NECTIN家族基因在肿瘤细胞中高表达,虽然这在不同PDAC患者之间存在显著异质性,但无论治疗状态如何,大多数组织学上都有NECTIN4表达和肿瘤细胞的区域共定位,这些结果都为靶向TIGIT-NECTIN轴以提高抗肿瘤T细胞活性提供了理论依据。
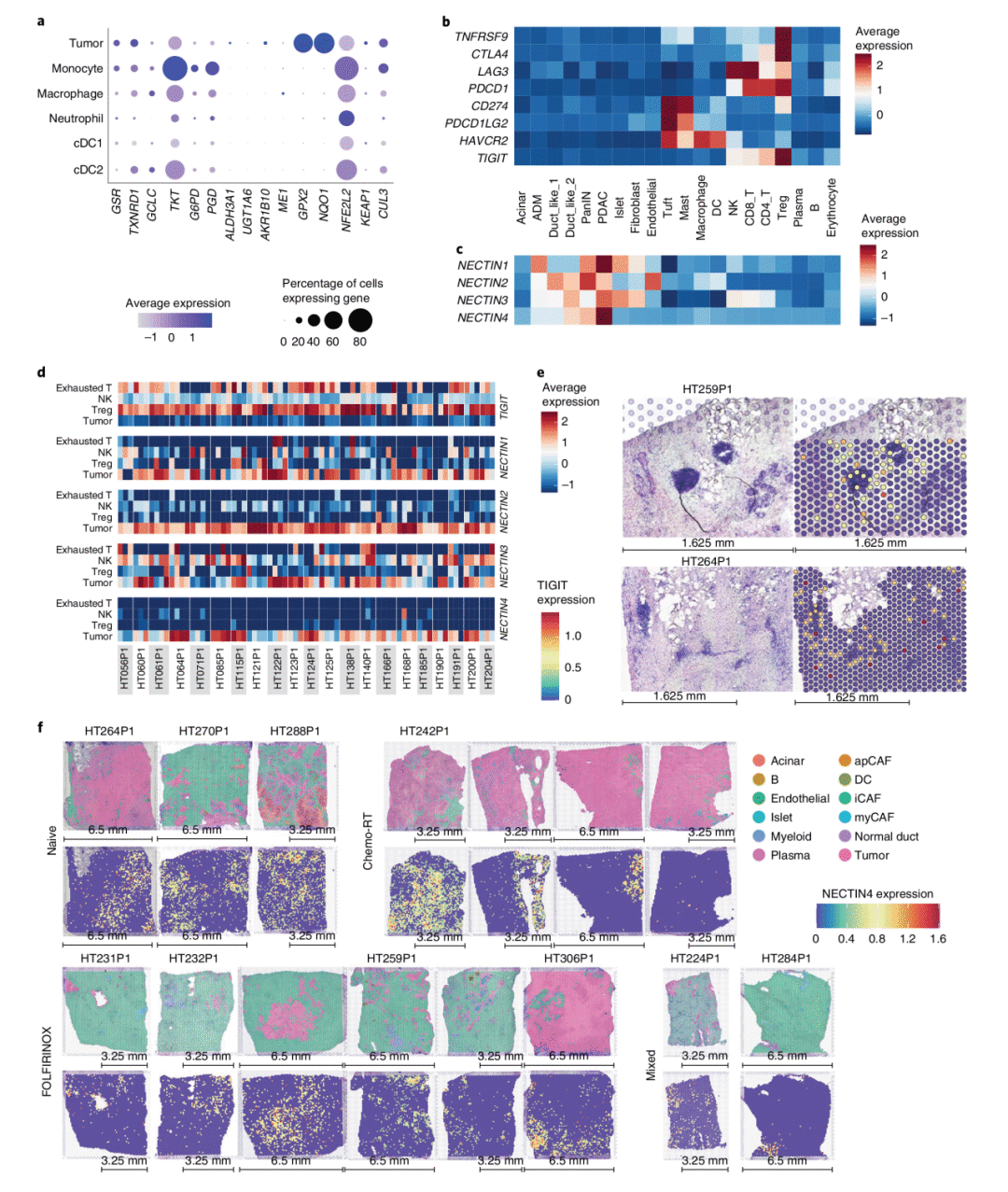
图8 PDAC免疫抑制的肿瘤微环境特征和治疗
总结
该研究通过单细胞转录组、空间转录组、Bulk转录组、蛋白质组、磷酸化修饰组,全外显子测序及显微成像技术,分析了来自31例PDAC患者的83个样本,发现了PDAC的大量异质性,同时解析了胰腺癌发生的两个关键过渡点,即从正常细胞到癌变前细胞的转变,以及从癌变前细胞向胰腺癌细胞的转变的分子层面信息,最后也阐释了癌细胞对免疫疗法耐受性的分子机制,提出了TIGIT-NECTIN作为潜在的干预靶点,为PDAC治疗提出了具有临床意义的高价值数据资源。
中科优品推荐
【中科新生命】利刃出鞘!单细胞转录组和空细胞转录组两产品优势互补,珠联璧合,中科新生命可提供完整的空间多组学联合研究 “一站式”解决方案,全面助力各位老师勇攀科研高峰!诚意满满,快来联系我们吧!