上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Nature Plants 项目文章 | 浙大郑绍建/丁忠杰团队揭秘ALR1磷酸化动态调控植物铝感应能力的分子机制
354 人阅读发布时间:2025-05-16 11:31



研究材料
野生型拟南芥Col-0,pp2ch1#7/#9单突变体和pp2ch1h2#2/#7双突变体,alr1pp2ch1h2三突变体等材料
技术路线
步骤1: 定量磷酸化蛋白质组学发现植物抗铝性关键分子及其磷酸化修饰位点;
步骤2:突变实验证明关键分子ALR1磷酸化状态对STOP_1依赖的铝信号传导和抗性的影响;
步骤3:调控关键分子ALR1修饰发生的去磷酸化激酶(PP2CH1和PP2CH2)发现与鉴定;
步骤4:进一步解析ALR1(Ser696/698)磷酸化与铝结合分子机制(磷酸化激酶PBL27发现);
步骤5:体外磷酸化实验验证PP2CH1/2和PBL27在ALR1磷酸化中的作用。
研究结果
1. 植物抗铝性关键分子及其磷酸化修饰位点
该研究首先在定量磷酸化蛋白质组学的分析中,发现铝处理显著抑制了铝受体ALR1的两个Ser位点(S696/698)的磷酸化水平,且随着铝浓度和处理时间的增加而加剧。表达ALR1(Ser696/698)磷酸化模拟变体(ALR1(S2D))的植物表现出铝敏感性增加,铝诱导的STOP_1积累减弱。而表达去磷酸化变体(ALR1(S2A))植物变化则相反。结果提示ALR1(Ser696/698)的磷酸化状态动态响应铝处理,并影响STOP_1蛋白的积累。前期研究表明铝离子结合到ALR1增强了其与共同受体BAK1的相互作用和互磷酸作用,进一步作者通过体外磷酸化、双分子荧光互补(BiFC)和pull-down等实验表明ALR1S696/698的去磷酸化能够促进ALR1与共受体BAK1的互作及相互磷酸化,进而激活STOP_1依赖的抗铝信号通路。
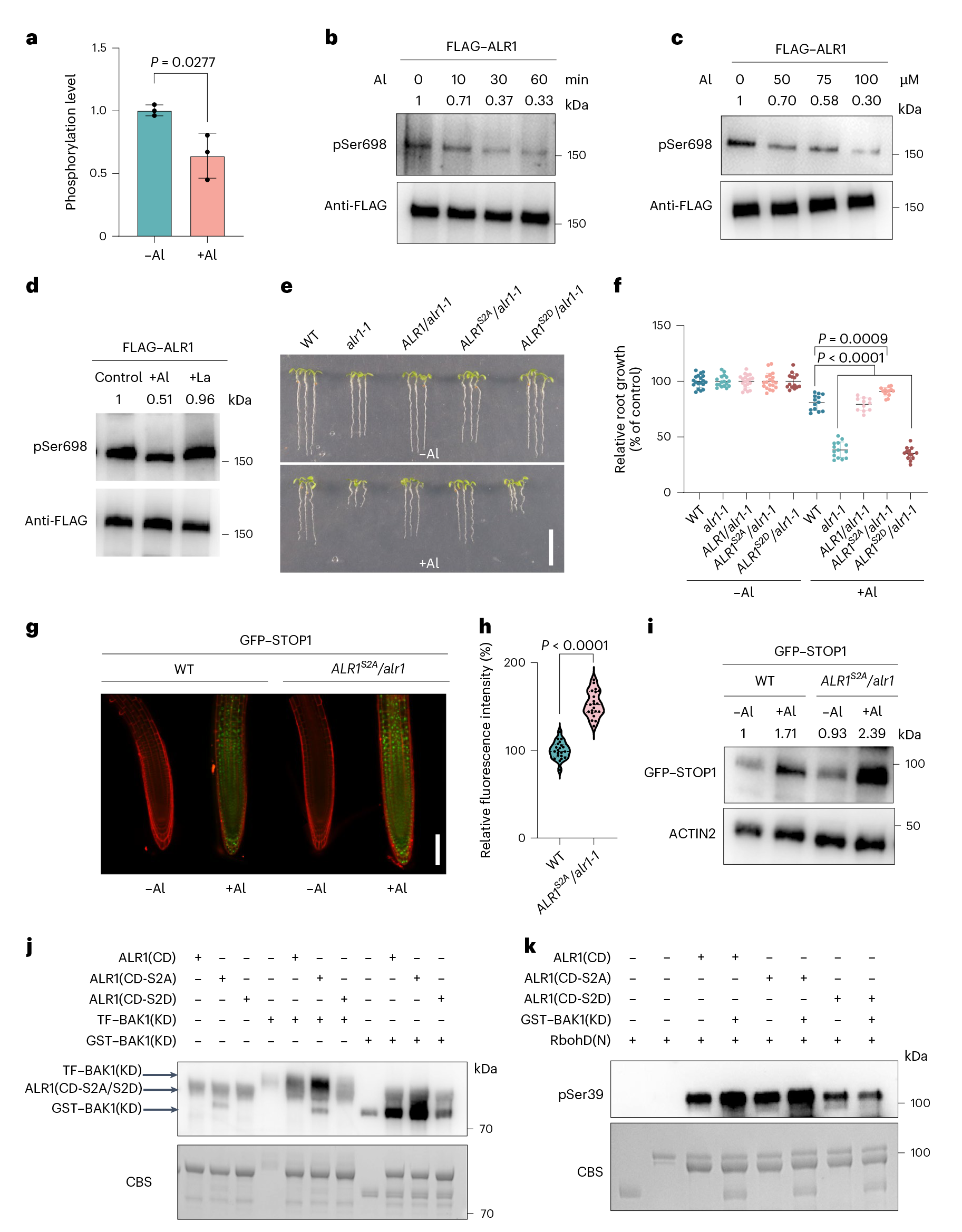 图1 ALR1(Ser696/698)的磷酸化抑制铝信号传导
2. PP2CH1/2与ALR1相互作用并使其去磷酸化
鉴于铝(Al)处理后ALR1(Ser696/698)的快速去磷酸化,接下来研究团队探究介导这一过程发生的去磷酸化激酶。主要关注植物中主要的磷酸酶家族PP2Cs,通过BiFC、Pull-down和CO-IP实验,鉴定了一类PP2C型磷酸酶(PP2CH1和PP2CH2)可与ALR1发生相互作用。点突变实验及pSer698抗体检测也表明PP2CH1/2使ALR1(丝氨酸696/698)去磷酸化。
图1 ALR1(Ser696/698)的磷酸化抑制铝信号传导
2. PP2CH1/2与ALR1相互作用并使其去磷酸化
鉴于铝(Al)处理后ALR1(Ser696/698)的快速去磷酸化,接下来研究团队探究介导这一过程发生的去磷酸化激酶。主要关注植物中主要的磷酸酶家族PP2Cs,通过BiFC、Pull-down和CO-IP实验,鉴定了一类PP2C型磷酸酶(PP2CH1和PP2CH2)可与ALR1发生相互作用。点突变实验及pSer698抗体检测也表明PP2CH1/2使ALR1(丝氨酸696/698)去磷酸化。
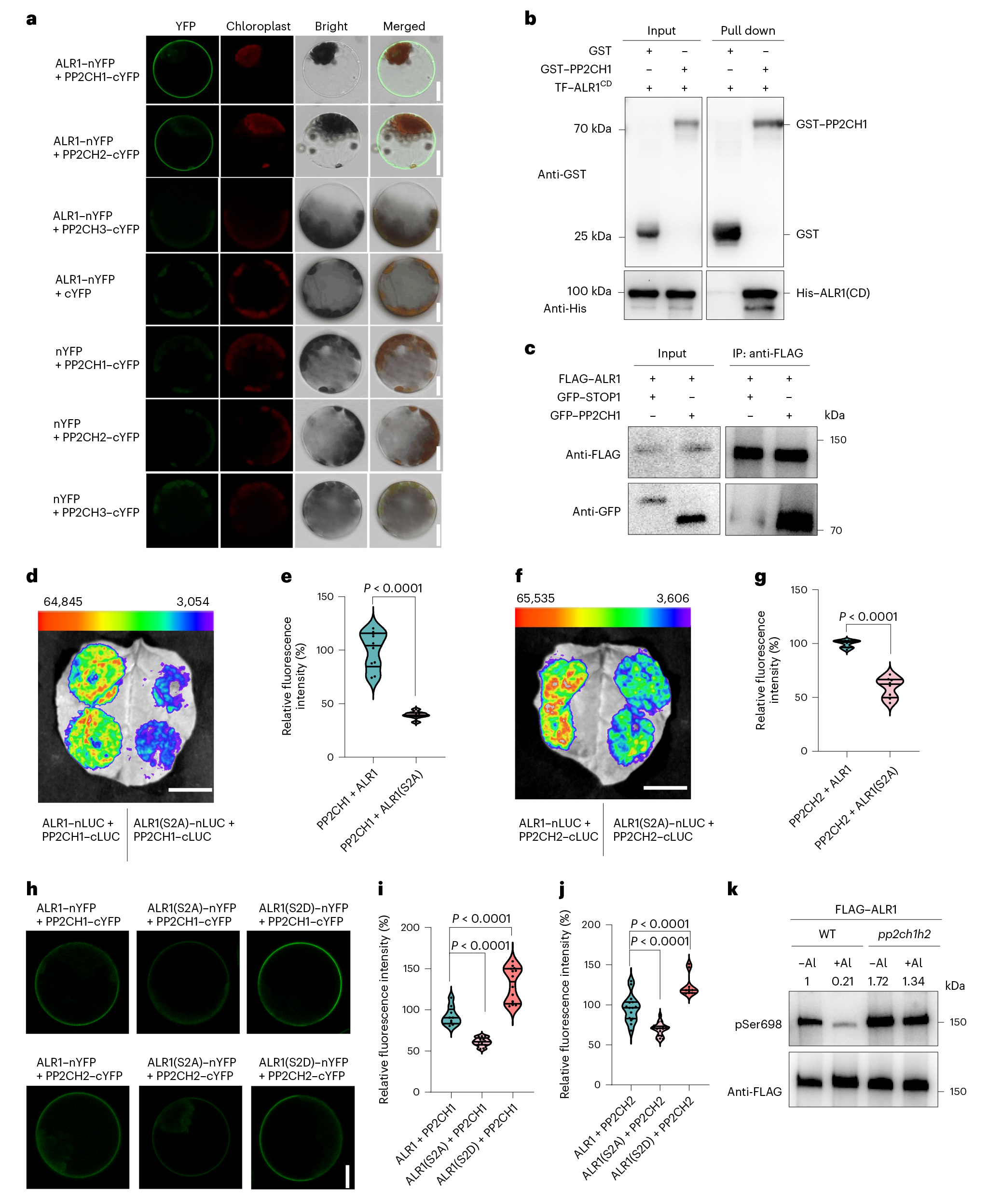 图2 PP2CH1/2与ALR1相互作用并使其去磷酸化
3. PP2CH1/2调控铝信号传导和抗性分子机制
为了评估PP2CH1/2是否赋予铝抗性,研究团队在铝处理下构建了对应的突变体,结合Morin、苏mu精染色和铝含量分析。结果表明PP2CH1/2通过促进铝的排除来增强铝抗性,而这一过程依赖于STOP_1。此外,BiFC和体外磷酸化实验显示,PP2CH1/2促进了ALR1和BAK1之间的相互作用和磷酸化。铝胁迫下,植物迅速增加蛋白质磷酸酶和PP2CH1/2的积累,以及ALR1与PP2CH1/2之间的相互作用。综上所述,这些发现表明PP2CH1/2负责ALR1S696/698的去磷酸化。铝离子能够快速诱导PP2CHs蛋白累积并促进其与受体ALR1的互作。PP2CHs功能缺失能够显著提高ALR1S696/698的磷酸化水平,进而抑制STOP_1依赖的抗铝信号途径。
图2 PP2CH1/2与ALR1相互作用并使其去磷酸化
3. PP2CH1/2调控铝信号传导和抗性分子机制
为了评估PP2CH1/2是否赋予铝抗性,研究团队在铝处理下构建了对应的突变体,结合Morin、苏mu精染色和铝含量分析。结果表明PP2CH1/2通过促进铝的排除来增强铝抗性,而这一过程依赖于STOP_1。此外,BiFC和体外磷酸化实验显示,PP2CH1/2促进了ALR1和BAK1之间的相互作用和磷酸化。铝胁迫下,植物迅速增加蛋白质磷酸酶和PP2CH1/2的积累,以及ALR1与PP2CH1/2之间的相互作用。综上所述,这些发现表明PP2CH1/2负责ALR1S696/698的去磷酸化。铝离子能够快速诱导PP2CHs蛋白累积并促进其与受体ALR1的互作。PP2CHs功能缺失能够显著提高ALR1S696/698的磷酸化水平,进而抑制STOP_1依赖的抗铝信号途径。
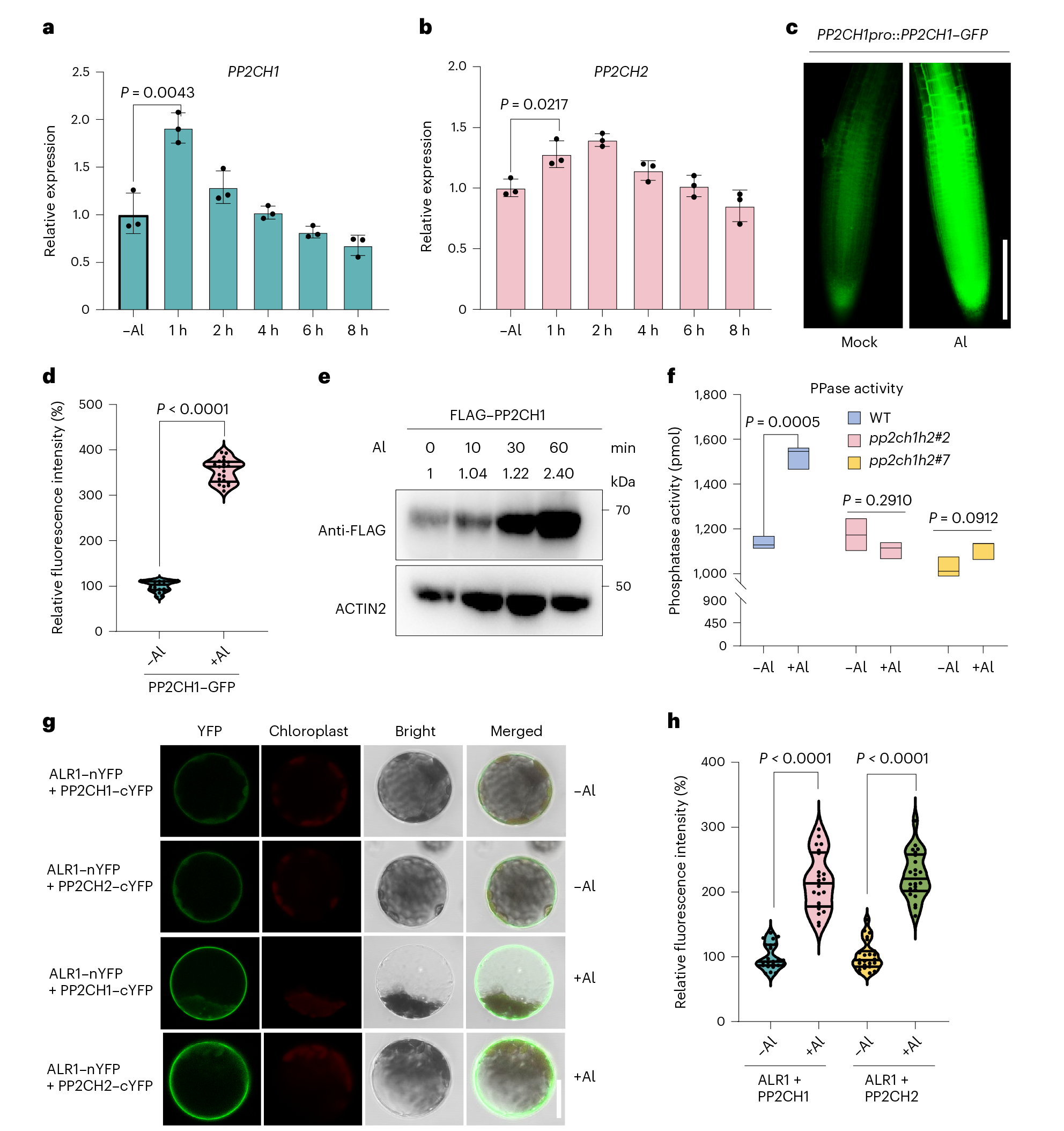 图 3 PP2CH1/2调控铝信号传导和抗性分子机制
4. ALR1(Ser696/698)磷酸化激酶发现
鉴定出PP2CH1/2作为ALR1(Ser696/698)的去磷酸化激酶后,研究团队进一步寻找负责其磷酸化的激酶。作者在一项独立研究中,生成了一个RLK过表达库,以克服RLK之间的高度功能冗余。筛选该库后鉴定出RLCK PBL27(受体样细胞质激酶)作为Al抗性的负调控因子,PBL27的过表达显著降低了Al抗性。通过实验验证证明PBL27可磷酸化ALR1,并利用质谱分析鉴定出其目标磷酸化位点为丝氨酸696和丝氨酸698。
图 3 PP2CH1/2调控铝信号传导和抗性分子机制
4. ALR1(Ser696/698)磷酸化激酶发现
鉴定出PP2CH1/2作为ALR1(Ser696/698)的去磷酸化激酶后,研究团队进一步寻找负责其磷酸化的激酶。作者在一项独立研究中,生成了一个RLK过表达库,以克服RLK之间的高度功能冗余。筛选该库后鉴定出RLCK PBL27(受体样细胞质激酶)作为Al抗性的负调控因子,PBL27的过表达显著降低了Al抗性。通过实验验证证明PBL27可磷酸化ALR1,并利用质谱分析鉴定出其目标磷酸化位点为丝氨酸696和丝氨酸698。
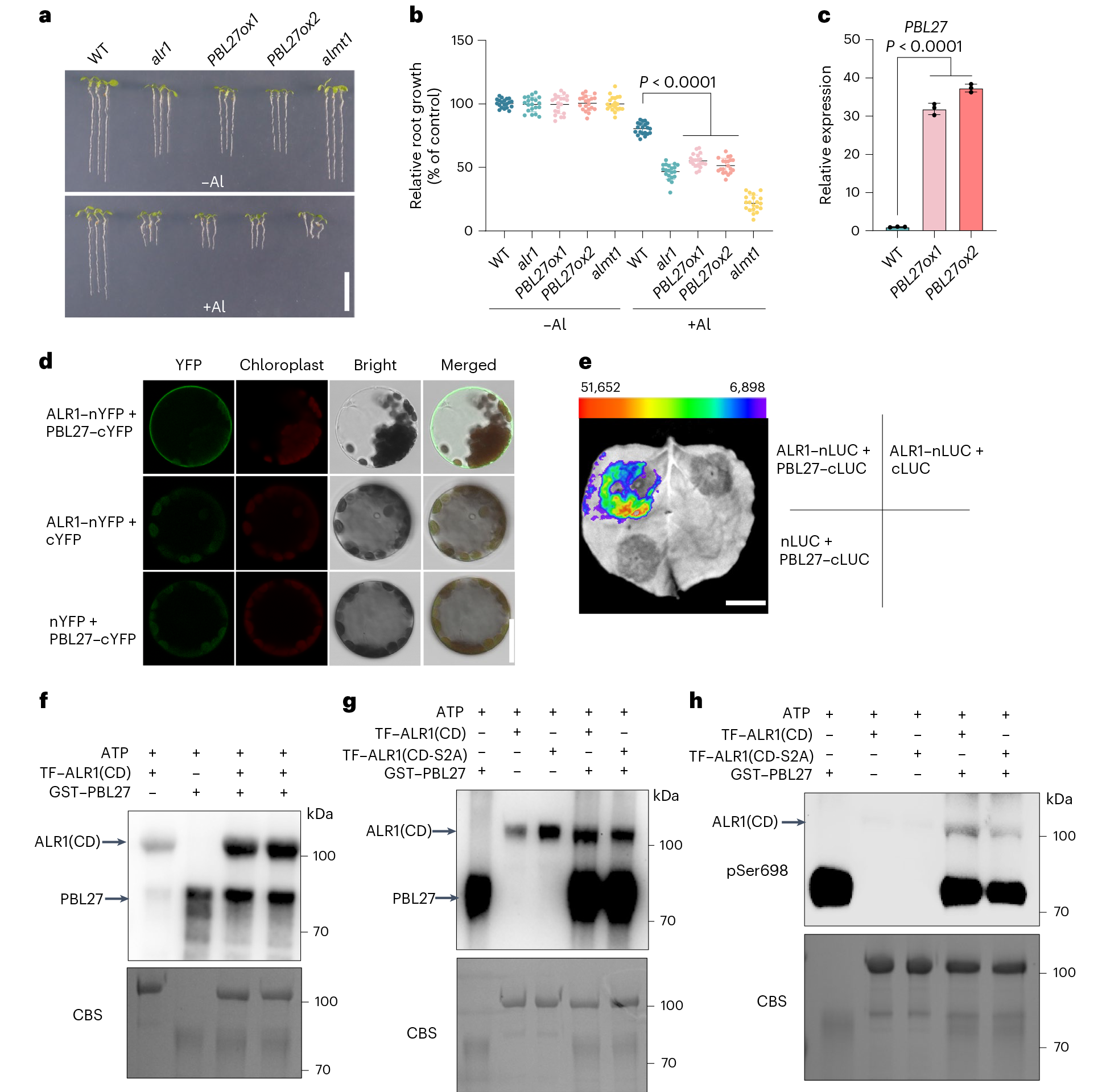 图4 PBL27通过磷酸化ALR1(Ser696/698)抑制铝抗性
5. ALR1受体介导的磷酸化转换机制控制植物的铝感应能力
进一步通过体外实验发现并验证,ALR1(Ser696/698)的磷酸化状态与铝离子的结合之间存在协同或加成效应,这种效应增强了ALR1与BAK1的相互作用和互磷酸化。具体来说,ALR1(Ser696/698)的磷酸化与通过四个半胱氨酸残基(Cys939/Cys944/Cys985/Cys987)介导的铝结合共同促进了ALR1-BAK1复合物的形成,并在一定程度上增强ALR1的激酶活性,从而促进铝信号传导。
图4 PBL27通过磷酸化ALR1(Ser696/698)抑制铝抗性
5. ALR1受体介导的磷酸化转换机制控制植物的铝感应能力
进一步通过体外实验发现并验证,ALR1(Ser696/698)的磷酸化状态与铝离子的结合之间存在协同或加成效应,这种效应增强了ALR1与BAK1的相互作用和互磷酸化。具体来说,ALR1(Ser696/698)的磷酸化与通过四个半胱氨酸残基(Cys939/Cys944/Cys985/Cys987)介导的铝结合共同促进了ALR1-BAK1复合物的形成,并在一定程度上增强ALR1的激酶活性,从而促进铝信号传导。
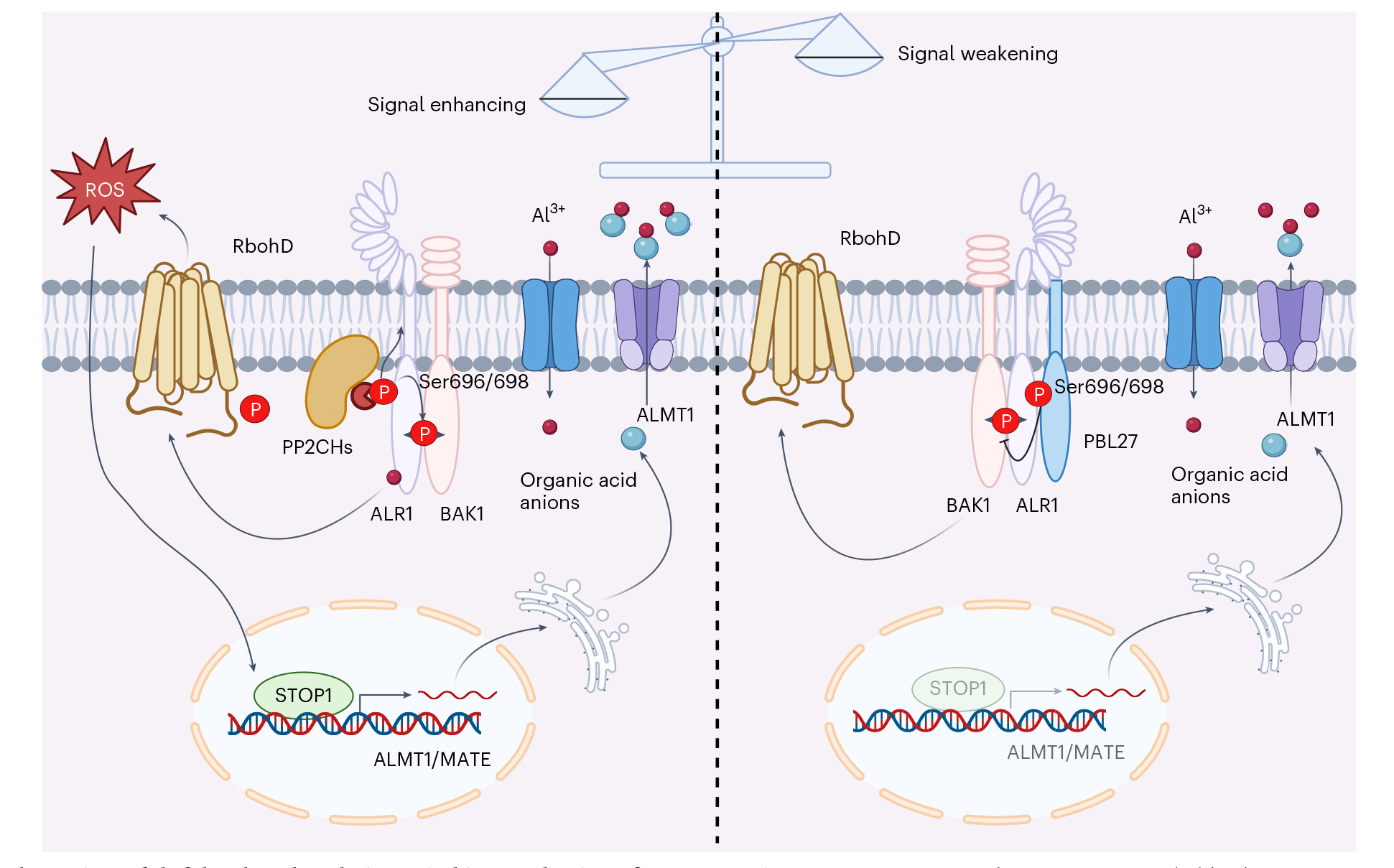 图5 ALR1受体介导的磷酸化转换机制控制植物的铝感应能力
图5 ALR1受体介导的磷酸化转换机制控制植物的铝感应能力
文章小结
研究解析了铝离子受体ALR1(Ser696/698)的磷酸化状态在植物铝感应中起关键作用。PP2CH1/2通过去磷酸化ALR1促进其与BAK1的相互作用,增强铝抗性;而PBL27通过磷酸化ALR1抑制铝抗性,形成磷酸化开关,以防止抗性通路的过度激活。该研究揭示了植物铝感应的复杂调控机制,为作物抗铝育种提供了理论基础。使得植物在满足抗铝需求的同时,达到生长最大化的目的,进而为提高酸性土壤上作物的生产力提供理论依据和新的基因资源。中科新生命提供多种修饰组学检测及鉴定服务。欢迎各位老师前来咨询!
中科优品推荐 【中科新生命】极微量磷酸化蛋白组新突破,蛋白量要求低至50μg,下降90%,磷酸化位点检出突破2W!适用分选细胞、穿刺组织、小体积器官和FFPE切片等样本。欢迎感兴趣的老师了解咨询。