上海中科新生命生物科技有限公司
18 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
项目文章Cell Metab(IF 29.0)| 中国科学技术大学揭示滞育样肿瘤细胞形成及调控机制
673 人阅读发布时间:2023-12-27 13:17

胚胎滞育是一种独特的生物学现象,是许多哺乳动物面对恶劣环境时选择的一种通过可逆地阻滞胚胎发育,以提高繁殖适合度的生存策略。最近研究显示,肿瘤细胞面对化疗药物时也会表现出类似状态,从而降低肿瘤细胞死亡率。然而,肿瘤细胞向滞育样状态(缓慢增殖,耐化疗)转变的分子机制仍需深入研究。
2023年8月4日,中国科学技术大学刘连新、郑州大学医学科学院吴缅教授团队合作在Cell Metabolism(IF 29.0)发表题为“The diapause-like colorectal cancer cells induced by SMC4 attenuation are characterized by low proliferation and chemotherapy insensitivity”的文章,该研究利用转录组学、单细胞测序、非靶向代谢组学、代谢流分析等技术手段,发现染色体结构维持蛋白4 (SMC4)表达下调会诱导结直肠癌滞育样癌细胞(DLCC)呈现低增殖和对化疗不敏感的特点,为非遗传性化疗耐药机制提供了新的见解。中科新生命为该研究提供了非靶向代谢组检测服务。

研究材料
SMC4敲低/不敲低的结直肠癌细胞,SMC4敲除/不敲除的结直肠癌小鼠模型技术路线
步骤1:转录组学揭示SMC4是结直肠癌细胞滞育样状态的负调节因子; 步骤2:SMC4下调诱导的滞育样癌细胞(DLCC)低增殖和化疗不敏感; 步骤3:单细胞测序、非靶向代谢组学、代谢流分析发现SMC4下调导致DLCC糖酵解和乳酸升高; 步骤4:组蛋白乳酸化促进DLCC中ABC转运蛋白表达增加导致化疗不敏感; 步骤5:SMC4下调抑制PGAM1表达导致F-肌动蛋白组装减少抑制DLCC增殖; 步骤6:SMC4抑制增强原位小鼠模型化疗不敏感性且与结直肠癌患者良好预后相关。研究结果
1. SMC4是结直肠癌细胞滞育样状态的负调节因子
研究首先整合包括营养匮乏肿瘤细胞、化疗后肿瘤组织、小鼠滞育胚胎在内的三个滞育相关的转录组数据集,发现SMC4下调在多种滞育相关事件中普遍存在。接着在结直肠癌细胞中敲低SMC4开展转录组学分析,发现存在与滞育胚胎相似的转录模式。进一步通过药物敏感性测定,肿瘤细胞3D培养和荷瘤小鼠等实验均证实SMC4下调重现滞育样癌细胞(DLCC)的显著特征,包括可逆的生长停滞和化学敏感性降低。这些结果表明SMC4可以调控肿瘤细胞滞育样状态。
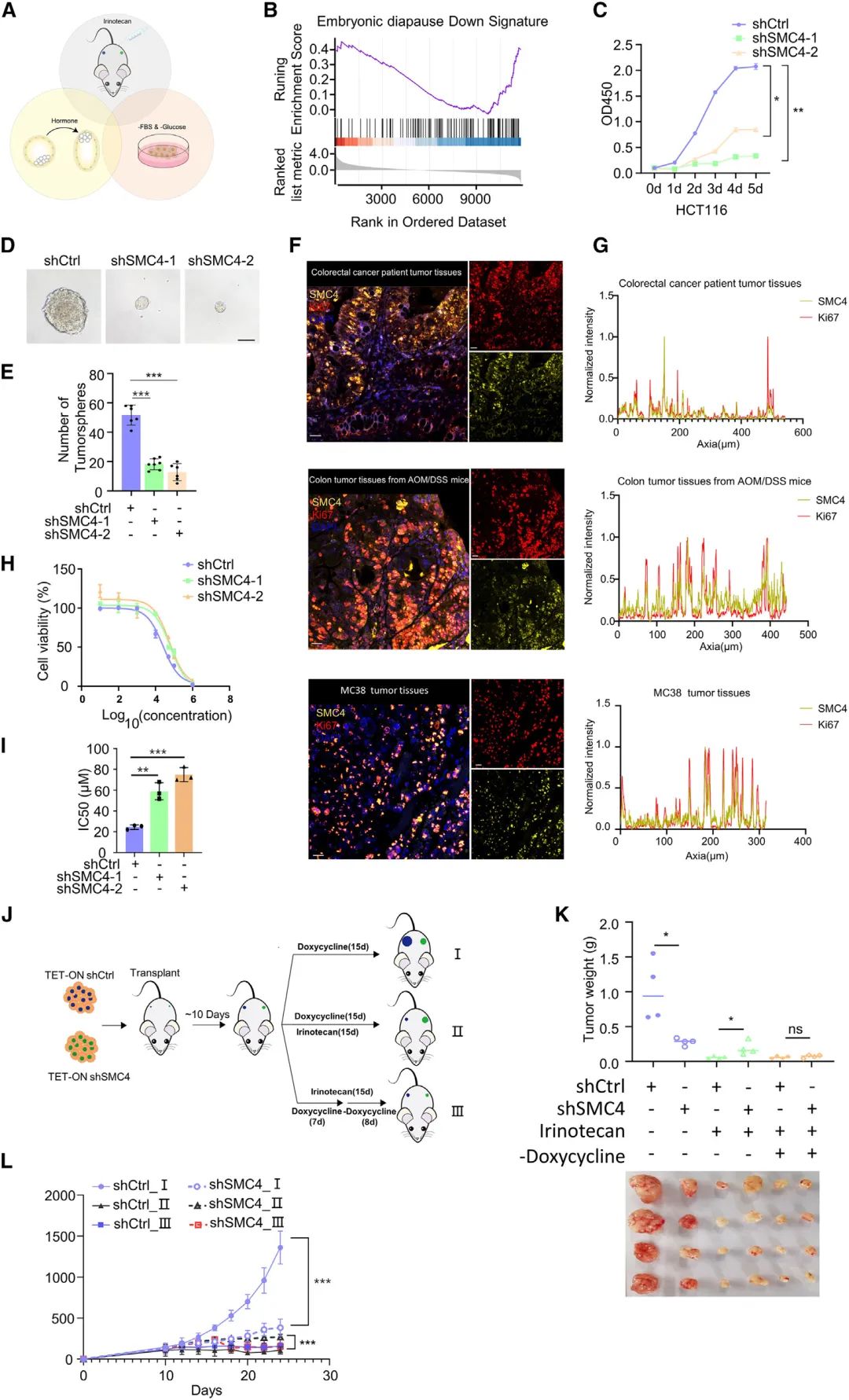
图1 SMC4是结直肠癌细胞滞育样状态的负调节因子
2. DLCC中糖酵解和乳酸生成的升高促进对化疗的不敏感
通过对结直肠癌肿瘤组织进行scRNA-seq发现,SMC4主要在快速循环癌细胞(fast-cycling cancer cells)中表达,表明其与增殖有关。此外,与其他慢循环细胞(slow-cycling tumor cells)相比,对缺氧有反应的慢循环肿瘤细胞显示出最低SMC4表达,且这群细胞具有最高的糖酵解得分,表明由低SMC4表达定义的滞育样癌细胞(DLCC)显著增强了糖酵解,与先前的发现一致,即滞育胚胎和营养剥夺的细胞具有高度的糖酵解能力。进一步研究发现在结直肠癌细胞中敲低SMC4会促进三种糖酵解酶(HK2、PFKL、ALDOC)的表达,增加乳酸产生,同时抑制甘油酸突变位酶1(PGAM1)。
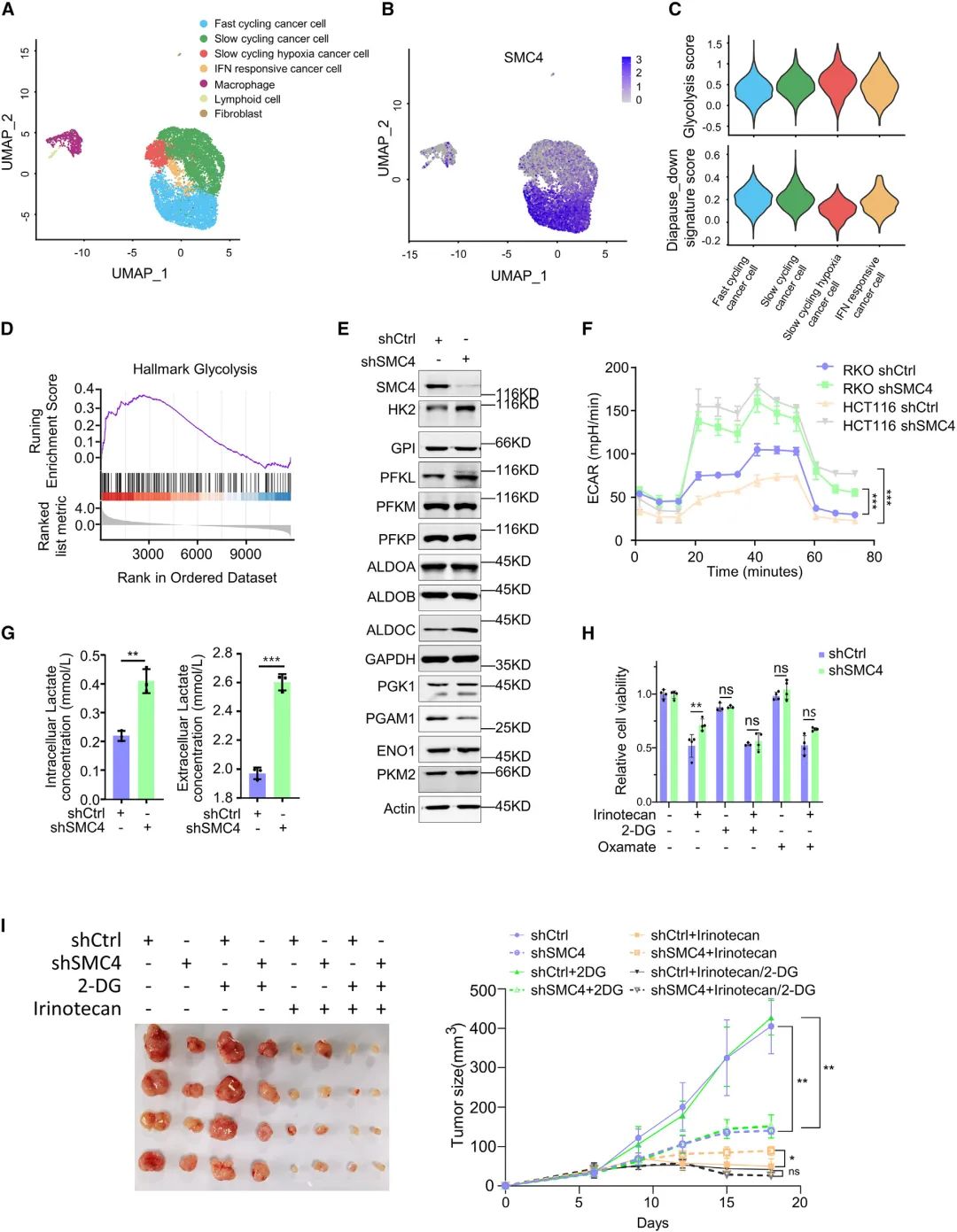
图2 DLCC中糖酵解和乳酸生成的升高促进对化疗的不敏感
3. 组蛋白乳酸化促进了DLCC中ABC转运蛋白的增加
乳酸通过新型表观遗传修饰—乳酸化广泛参与各种生理病理过程。DLCC对药物抵抗依赖于乳酸的水平,研究者发现SMC4下调后,肿瘤细胞中的泛乳酸化水平的显著上调并且H4K12位点的乳酸化修饰水平变化最为显著,进一步通过CUT&TAG技术和转录组联合分析,发现负责药物泵出的ABC转运蛋白启动子区域H4K12la显著富集,通过qPCR和ChIP-qPCR证实,ABCC2、ABCC3和ABCC10等通过H4K12la修饰而表达上调。结果表明高乳酸水平通过组蛋白乳酸化增加ABC转运蛋白表达,使肿瘤细胞对化疗不敏感。
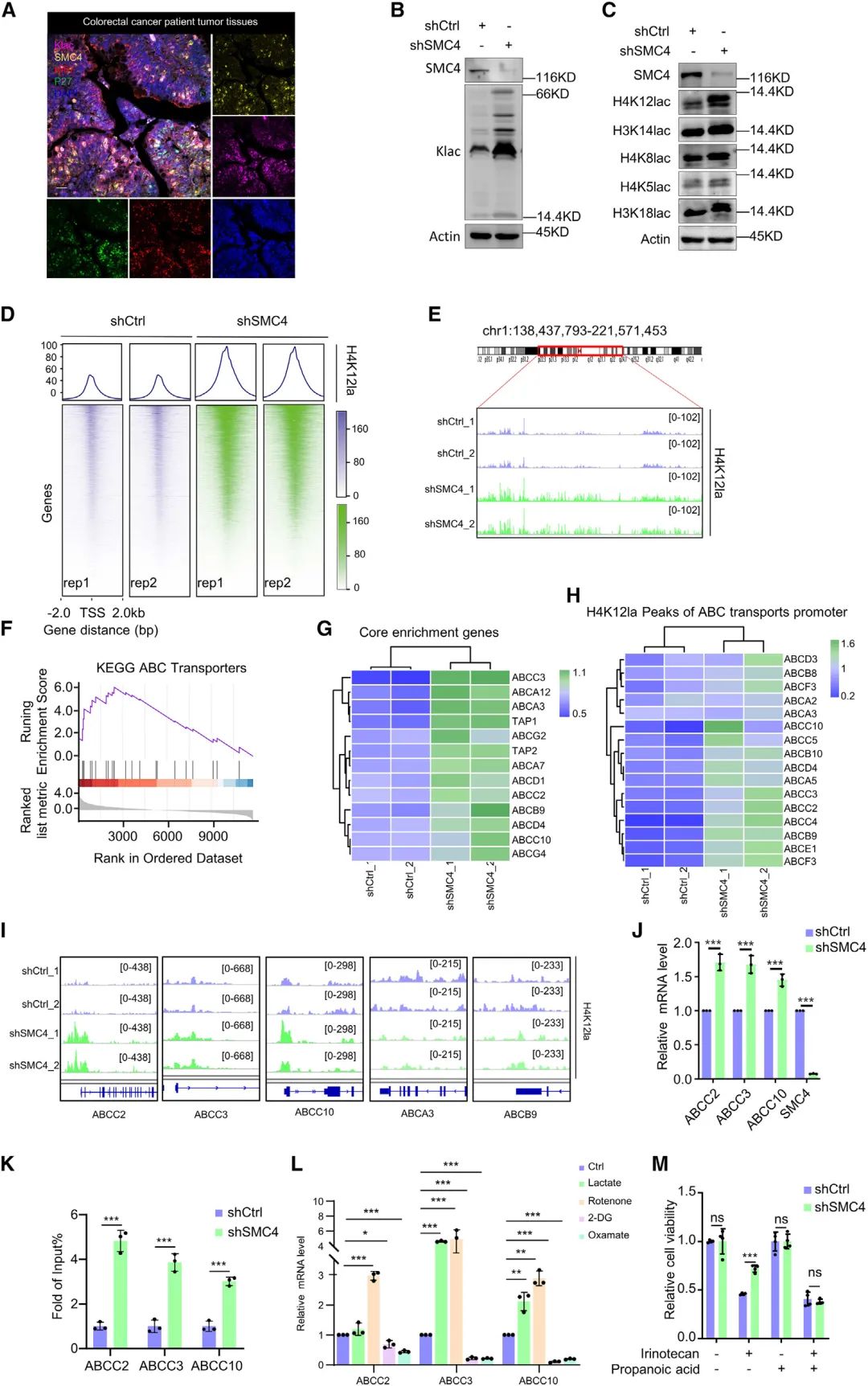
图3 组蛋白乳酸化促进了DLCC中ABC转运蛋白的增加
4. SMC4基因敲除后PGAM1的减少不影响嘌呤合成
前面研究者证实SMC4下调虽然引起代谢酶HK2,PFKL和ALDOC表达上调,但代谢酶PGAM1表达水平却是意外的下调。PGAM在糖代谢过程中扮演双重身份,一方面参与糖酵解过程,另一方面抑制戊糖磷酸途径(PPP)。研究者猜想PGAM1下调会导致PPP途径被抑制,从而影响嘌呤的从头合成,抑制细胞增殖。利用代谢流分析发现葡萄糖进入PPP途径的比例减小,但通过非靶向代谢组发现嘌呤代谢通路并没有下调反而显著上调,与假设不符。接着研究发现敲低SMC4,6PDGH酶活性约30%的下降但葡萄糖摄取增加大于2倍,这导致即使葡萄糖PPP通量受到影响,但由于整体糖代谢的来源增加,使得PPP得以维持。
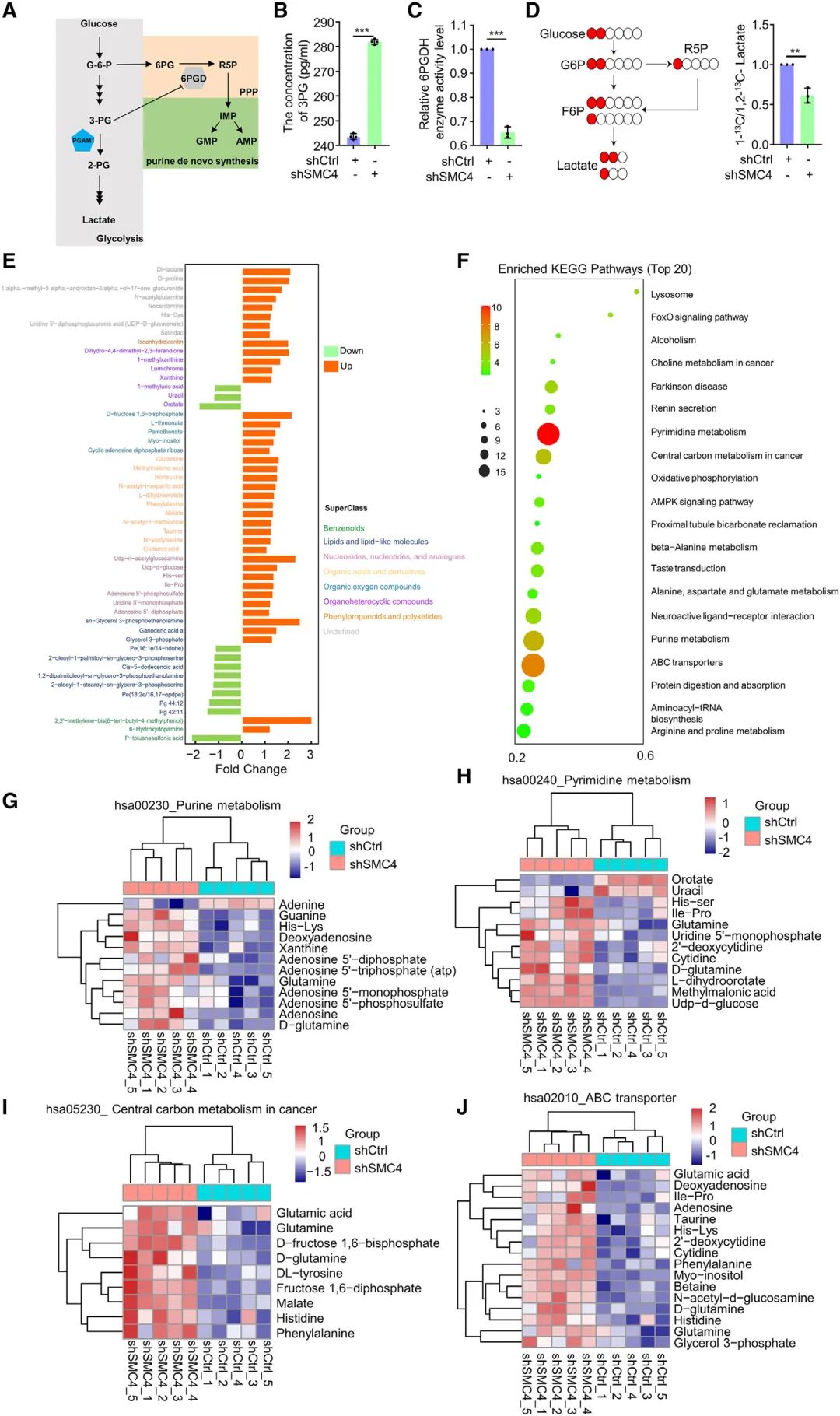
图4 SMC4基因敲除后PGAM1的减少不影响嘌呤合成
5. DLCC细胞分裂失败和多倍体是由于F-肌动蛋白组装减少引起
PGAM1下调与DLCC增殖能力下降是否存在联系?研究通过细胞形态观察发现DLCC细胞体积的增加并伴随多倍体现象。免疫荧光实验发现在SMC4下调时细胞收缩环形成失败,无法进行胞质分裂。先前的研究表明PGAM1通过与α-actin2直接结合发挥非酶促功能,促进F-actin组装。研究人员在DLCC中进行了PGAM1功能回补实验发现显著提升了F/G-actin比例,并一定程度上逆转了由SMC4下调导致的二倍体/多倍体细胞比例失调。这表明SMC4下调导致的PGAM1表达降低通过减弱胞质分裂促成细胞滞育样表型。

图5 DLCC细胞分裂失败和多倍体是由于F-肌动蛋白组装减少引起
6. SMC4抑制增强了原位小鼠模型的化疗不敏感性
随后研究者从胚胎发生和肿瘤发生的双重角度考虑SMC4在体内的意义及其与细胞滞育的关系。使用CRISPR-Cas9技术使SMC4缺失,在SMC4敲除小鼠中通过偶氮氧甲烷(AOM)/葡聚糖硫酸钠(DSS)诱导的结直肠原位肿瘤模型,发现SMC4敲除小鼠远端结肠肿瘤的数量和大小明显少于野生型小鼠,肿瘤组织中有丝分裂癌细胞的比例显著较低。伊立替康治疗显著抑制了肿瘤的发生,但SMC4敲除小鼠肿瘤组织的生长速度明显快于野生型幼鼠肿瘤,表明SMC4敲除小鼠肿瘤对化疗的敏感性降低。
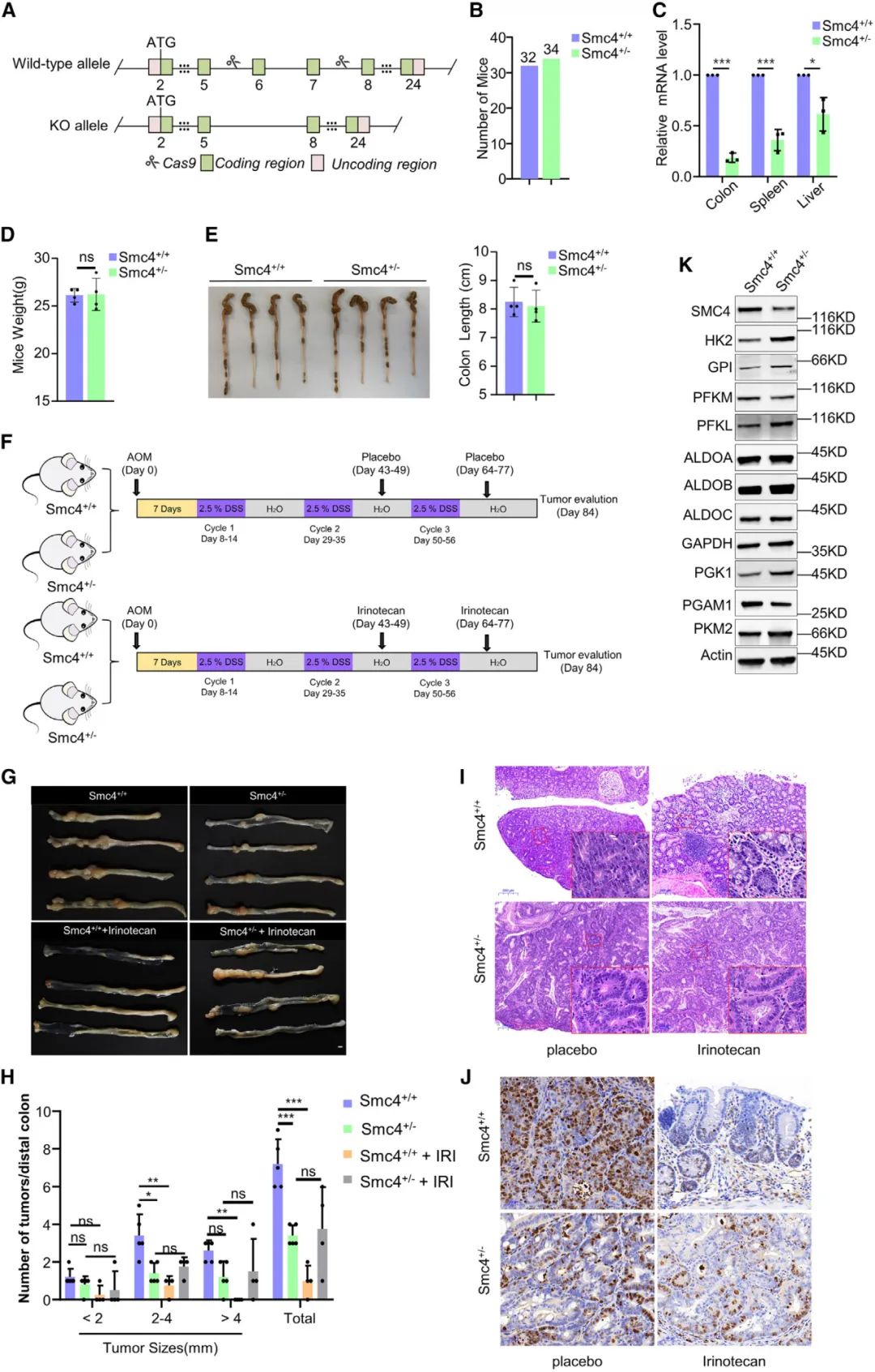
图6 SMC4抑制增强了原位小鼠模型的化疗不敏感性
7. SMC4表达与结直肠癌的良好预后相关
为了更好地了解SMC4在人类癌症中的临床意义,研究人员进一步探究了它的表达及其对患者预后的影响。通过TCGA数据库发现与正常结肠组织相比,SMC4在结直肠癌组织中高表达,且SMC4高表达与正向结果相关。此外,在一个独立的结直肠临床组织队列中,对SMC4表达的免疫组化检测在蛋白质水平上证实了这些发现,且记录的高SMC4表达对患者生存也有类似的积极影响。进一步发现化疗显著提高了SMC4高表达患者的生存率,但对SMC4低表达患者生存期无明显改善,表明SMC4低表达的肿瘤对化疗不敏感。
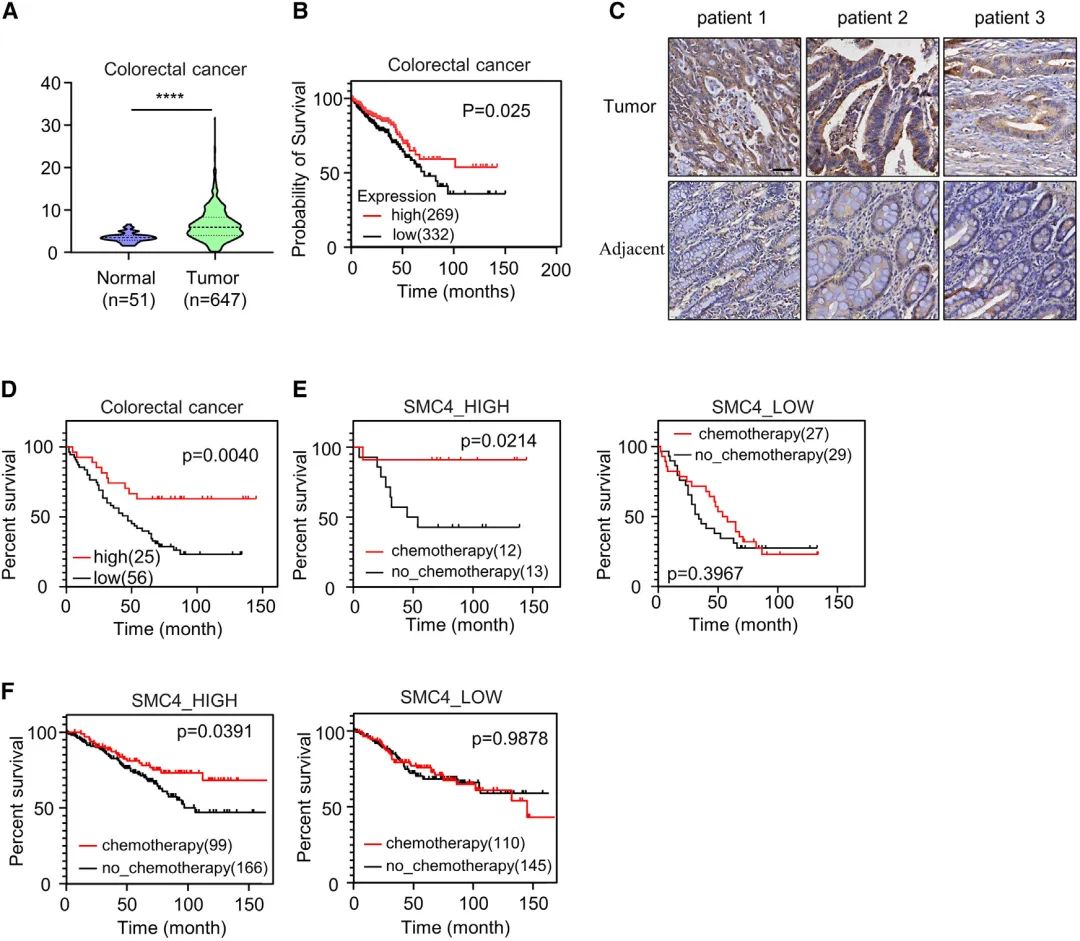
图7 SMC4表达与结直肠癌的良好预后相关
小结
该研究利用转录组学方法发现了SMC4是结直肠癌细胞滞育样状态的负调节因子,进而发现并验证了SMC4下调诱导的DLCC低增殖和化疗不敏感,随后利用单细胞测序、非靶向代谢组学、代谢流分析等技术手段深入解析SMC4下游的调控机制,发现SMC4下调导致DLCC糖酵解和乳酸升高,进而引起组蛋白乳酸化促进DLCC中ABC转运蛋白表达增加导致化疗不敏感,此外SMC4下调抑制PGAM1表达导致F-肌动蛋白组装减少抑制DLCC增殖。最后研究通过动物模型和临床样本揭示SMC4抑制增强原位小鼠模型化疗不敏感性且与结直肠癌患者良好预后相关。该研究增进人们对非遗传性药物抵抗机制的理解,同时也推进了肿瘤有氧糖酵解功能的认知,并有可能为精准肿瘤治疗提供治疗策略。
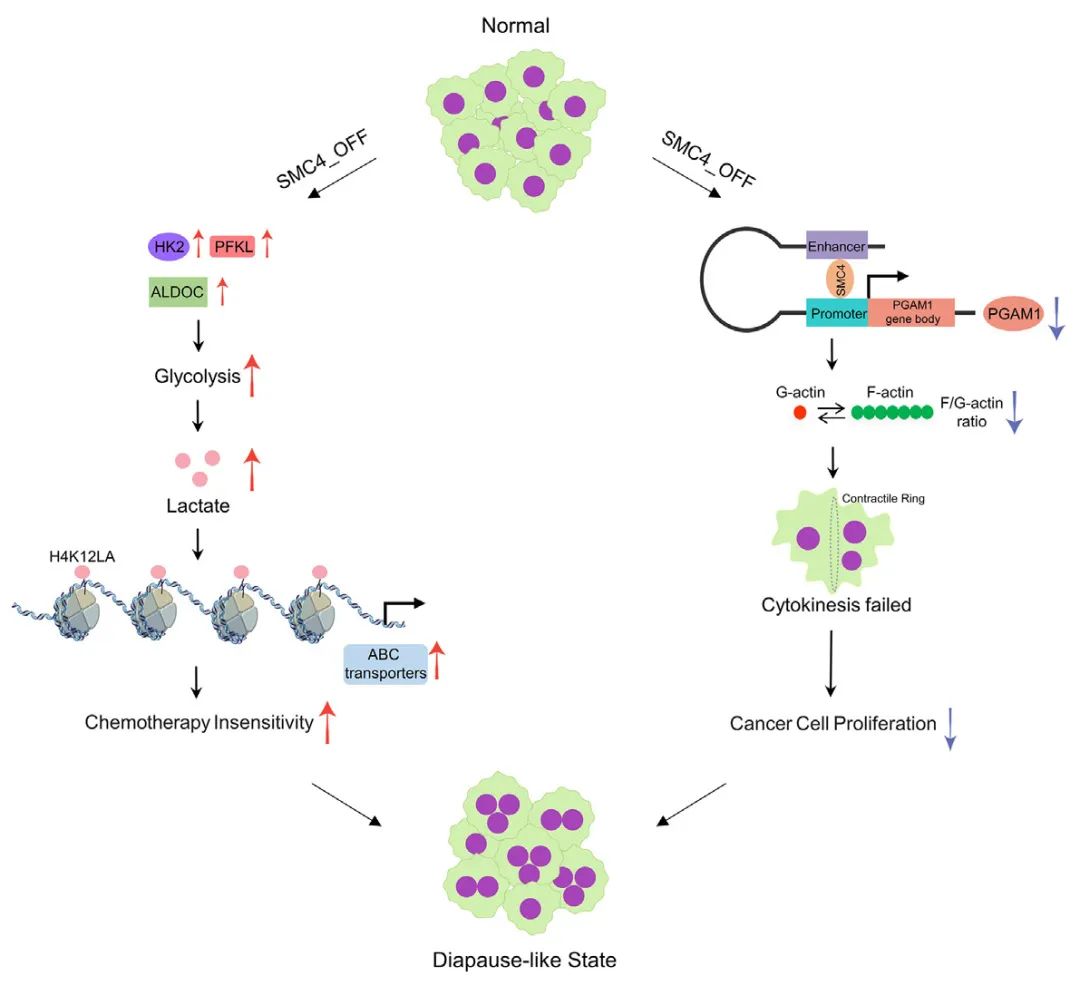
图8 作用机制模式图
中科优品推荐
【中科新生命】以蛋白质组、修饰组、代谢及脂质组等质谱服务为核心,并延伸打造微生物、转录组、时空多组学服务,已搭建完整的创新型多组学平台,为您的研究保驾护航!欢迎感兴趣的老师前来咨询!