上海中科新生命生物科技有限公司
18 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
5-10分的蛋白磷酸化文章都在研究什么?
357 人阅读发布时间:2023-11-01 09:22

翻译后修饰(PTM)作为一种灵活、高效的蛋白质活性调节方式,赋予了蛋白质丰富的功能,也体现了生命进化的智慧。磷酸化是蛋白质最广泛、最重要的翻译后修饰之一,几乎参与了所有的生命过程。因此,研究蛋白质磷酸化对揭示生理病理过程中的分子机制具有重要意义。
中科新生命从2011年开始提供商业化的磷酸化修饰蛋白质组学服务至今,已形成了从高通量检测到验证的完整技术平台,开发了特色激酶-药靶分析及磷酸化和其他组学的联合分析方案,已助力客户发表了几十篇高分文章。
中科新生命 磷酸化修饰蛋白质组产品



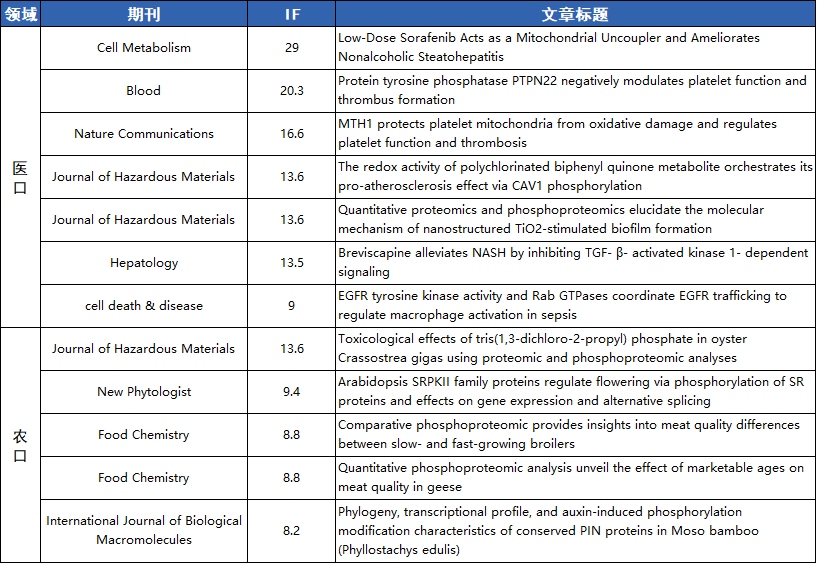
中科新生命 磷酸化修饰蛋白质组高分项目文章
接下来,请跟随小编一起看一看近两年的5-10分的文章都利用磷酸化修饰蛋白质组做了哪些研究吧!
医口
01
蛋白质组+磷酸化修饰蛋白质组联合,分析激酶药靶

Integrated proteomics and phosphoproteomics revealed druggable kinases in neoadjuvant chemotherapy resistant tongue cancer
蛋白质组和磷酸化蛋白质组联合揭示新辅助化疗耐药舌癌中的药靶激酶
影响因子:5.5
发表单位:印度生物信息研究院
本研究旨在探索新辅助化疗耐药舌癌中的蛋白质和磷酸化变化。主要结果:
① 蛋白质组共检测到7453个蛋白质,分析得到59个差异表达蛋白质;磷酸化修饰蛋白质组共检测到4150个蛋白的14450个磷酸化肽段,分析得到126个差异磷酸化肽段。
② 差异磷酸化事件共涉及191个激酶。
③ 激酶富集分析得到的排名前5激酶为:MAPK1、AKT1、MAPK、MAPK7、PKCζ。
④ 基于TCGA数据库的分析显示,前5个激酶的表达量在30%、21%、31%、26%和22%的患者中发生变化。
⑤ 在Therapeutic Target Database (TTD)中比对发现,很多激酶有已批准上市或正在临床实验的抑制剂药物。
总体,本研究分析了新辅助化疗耐药舌癌中异常表达的蛋白质和磷酸化,并发现了一些药靶激酶。
02
项目文章——磷酸化修饰蛋白质组揭示药物作用机制

Xanthatin suppresses pancreatic cancer cell growth via the ROS/RBL1 signaling pathway: In vitro and in vivo insights
苍耳亭通过ROS/RB1抑制胰腺癌细胞生长:体外和体内视角
影响因子:7.9
合作单位:中国科学技术大学附属第一医院/安徽医科大学
本研究旨在揭示从中草药苍耳中提取得到的一种化合物——苍耳亭对胰腺癌细胞生长的影响及相关分子机制。主要结果:
① 体外实验显示,苍耳亭抑制胰腺癌细胞增殖、侵袭和转移,并诱导细胞凋亡。
② 作者利用磷酸化修饰蛋白质组揭示苍耳亭影响的信号通路:共检测到3111磷酸化蛋白、8180磷酸化肽段和11060磷酸化位点;并分析得到1074个上调和1076个下调磷酸化肽段;其中RB1的磷酸化在苍耳亭处理后受到抑制;此外,苍耳亭处理增强了细胞的活性氧ROS水平,而已有研究表明ROS的确可以抑制RB1的磷酸化。
③ 抗氧化剂NAC可以逆转苍耳亭对细胞增殖的抑制及对细胞凋亡的诱导。这说明,ROS介导了苍耳亭对胰腺癌细胞的相关作用。
④ 体外小鼠胰腺癌移植瘤模型检测发现,苍耳亭抑制胰腺癌细胞生长。
综合体外和体内实验结果表明,苍耳亭通过ROS/RB1抑制胰腺癌细胞生长。
03
项目文章——磷酸化修饰蛋白质组揭示基因下游靶点

EGFR tyrosine kinase activity and Rab GTPases coordinate EGFR trafficking to regulate macrophage activation in sepsis
EGFR酪氨酸激酶活性和Rab GTPase 协同EGFR转运调控脓毒症中巨噬细胞激活
影响因子:9.685
合作单位:广东医科大学附属医院
本研究旨揭示巨噬细胞中EGFR在LPS(脂多糖)作用下的胞内转运过程及其生理意义。主要结果:
① LPS诱导脓毒症巨噬细胞表面EGFR的激活,并促进EGFR的表达。
② 抑制EGFR磷酸化显著降低了巨噬细胞膜中EGFR的表达,提示EGFR激酶活性在受体运输中起重要作用。为了发现EGFR激酶新的下游靶点,作者采用磷酸化修饰蛋白组检测EGFR的下游靶点。共得到11772个独特的磷酸位点,对应了8151个肽片段、3041个独特的蛋白质。其中Rab7a在S72位磷酸化发生显著变化。
③ MAPK14介导的Rab7a磷酸化调控了LPS激活的巨噬细胞的晚期内吞和EGFR降解。
④ LPS诱导的EGFR早期内化由Rab5a介导。
⑤ Rab10促进EGFR从高尔基体运输到细胞表面。
⑥ 抑制EGFR磷酸化可抑制巨噬细胞中糖酵解依赖性M1极化。
⑦ 抑制EGFR磷酸化通过激活PPARγ调节谷氨酰胺代谢(代谢组学)促进M2极化。
⑧ 抑制EGFR磷酸化可使M1表型转变为M2表型,减轻脓毒症引起的急性肺损伤。
该研究为EGFR作为脓毒症治疗的潜在靶点提供了有力的证据。
农口
01
项目文章——磷酸化修饰蛋白质组揭示抗逆胁迫的磷酸化变化

Comparative Phosphoproteomic Analysis Reveals the Response of Starch Metabolism to High-Temperature Stress in Rice Endosperm
磷酸化蛋白质组揭示水稻胚乳淀粉代谢对高温胁迫的响应
影响因子:5.6
合作单位:浙江大学
高温胁迫下的基因表达(mRNA和蛋白质表达水平)已有多项研究,而蛋白磷酸化变化缺少研究关注。本研究旨在揭示高温胁迫下两个品种的水稻胚乳中的蛋白磷酸化变化。主要结果:
① 连续高温5天的条件下就能对水稻颗粒垩白度和质量造成不可逆的损伤。
② 磷酸化修饰蛋白质组共检测到来自于3216个磷酸化蛋白的9994个磷酸化位点。两个品种分别得到410个和508个差异磷酸化位点。
③ 两个品种的差异磷酸化位点motif分析分别得到8个和15个含丝氨酸(Ser)或苏氨酸(Thr)的保守基序,其中有4个重合的基序。
④ 差异磷酸化蛋白的GO和KEGG分析显示了多种功能和通路的富集。
⑤ 分析淀粉代谢通路中的多种磷酸化变化。
⑥ 抗体验证了淀粉合成相关的磷酸化变化。
总体,本研究揭示了高温胁迫下水稻胚乳中的磷酸化改变,并重点分析或验证了淀粉代谢/淀粉合成过程的磷酸化变化。
02
项目文章——磷酸化修饰蛋白质组揭示抗逆胁迫的磷酸化变化

Soybean responds to phosphate starvation through reversible protein phosphorylation
大豆通过可逆的蛋白质磷酸化对磷酸盐饥饿进行响应
影响因子:6.5
合作单位:华南农业大学
本研究旨在揭示大豆在磷缺乏情况下的蛋白磷酸化变化。主要结果:
① 磷酸盐饥饿显著影响大豆生长,具体表现为大豆芽干重下降、大豆根干重上升、总根长度和表面积上升、根部磷酸盐浓度显著下降、APTase活性上调以及大豆根部硝酸盐浓度上调。
② 磷酸化修饰蛋白质组磷共检测得到2888个磷酸化蛋白质,其中427个存在显著差异变化(213个上调,214个下调)。
③ 上调和下调磷酸化肽段的motif分析分别得到3个和4个磷酸化位点基序。
④ 有12个差异磷酸化蛋白是离子转运蛋白或离子通道蛋白。
⑤ 分别有26个、7个和14个差异磷酸化蛋白参与碳代谢、氮代谢和信号转导。
⑥ 检测差异磷酸化蛋白的mRNA转录本的变化,其中20个上调磷酸化蛋白对应的mRNA中有15个上调,2个未发生变化,3个下调;16个下调磷酸化蛋白对应的mRNA中,有7个下调,5个未发生变化,4个上调。
⑦ 鉴于参与硝酸盐同化作用的硝酸盐还原酶GmNR4的磷酸化上调,作者分别通过将该蛋白491位的丝氨酸突变为丙氨酸(磷酸化缺失型突变)或突变为天冬氨酸(磷酸化激活型突变)检测了它的相关功能。结果显示,GmNR4活性受到491磷酸化状态的调控。此外,实验明确GmNR4磷酸化不影响其亚细胞定位。
总体,本研究揭示了大豆通过可逆蛋白磷酸化适应磷酸盐饥饿的复杂调控途径。
03
项目文章——磷酸化修饰蛋白质组揭示激酶底物

Arabidopsis SRPKII family proteins regulate flowering via phosphorylation of SR proteins and effects on gene expression and alternative splicing
SRPKII家族蛋白质通过磷酸化SR蛋白以及对基因表达和可变剪接的作用调节拟南芥的开花
影响因子:9.4
发表单位:山东师范大学
本研究旨在揭示SR蛋白特异性激酶SRPK在植物中的精细作用机制。主要结果:
① SRPK2和SRPK4基因突变,突变体表现出开花延迟、花瓣异常、角质化叶序排列异常和花不对称。
② 蛋白定位实验表明,SPRKII在幼苗、茎尖、莲座、茎叶、花和叶柄中广泛表达。这意味着SRPKII可能在整个拟南芥生命周期的发育过程中发挥作用。
③ 磷酸化修饰蛋白质组检测SRPKII的潜在下游底物。共鉴定到11200个磷酸化肽段,15985个磷酸化位点,对应于4834个磷酸化蛋白。差异比较共得到760个差异磷酸化肽段,其中349个上调,411个下调。SR45、SC35、SCL30A和RSZ21的RS结构域磷酸化水平显著下调,说明这4种SR蛋白中RS结构域的磷酸化主要受SPRKII控制。
④ SRPKIIs与SR蛋白亚类相互作用,并影响其亚细胞定位。
⑤ SR45的磷酸化影响ASAP(凋亡剪接相关蛋白)复合体的组装。
⑥ RNA测序显示,SRPKII参与基因转录和可变剪接。
⑦ SRPKII调节一个控制拟南芥开花时间的重要负调控因子FLC的基因转录和剪接。
⑧ 在SR45和SR35-scl的突变样本中,SRPKII调控的可变剪接事件发生变化。
总体,SRPKII通过调节特定SR蛋白的磷酸化和定位来调节转录和选择性剪接,最终调节FLC (Flowering Locus C)的转录以及选择性剪接来控制拟南芥的开花时间。
小结
由以上的文献我们可以看出来,这些5-10分的文章,磷酸化修饰蛋白质组都为研究提供了线索指引(如发现磷酸化变化、异常活性的激酶、潜在的激酶底物等),基于组学结果可锁定一些关键分子或功能/通路,再进行下游探索(可再结合其他组学技术)。此外,不难看出,随着文章影响因子的升高,研究揭示的分子机制程度也越精细,如磷酸化位点功能的验证、更下游作用机制探索等。
中科优品推荐
【中科新生命】提供全方位、不同形式的磷酸化修饰组:DIA磷酸化、4D-Labelfree磷酸化、TMT磷酸化、PRM磷酸化,以及磷酸化与蛋白组、磷酸化与代谢组、磷酸化与O-GlcNAc糖基化的联合分析。欢迎感兴趣的老师前来咨询。