上海中科新生命生物科技有限公司
18 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Cell Metab (IF 27.3)| 微量蛋白质组学揭示单细胞组学发现的关键细胞亚群功能异质性
904 人阅读发布时间:2022-05-13 19:01
脂肪组织适应生理,病理和环境变化的能力非常出色。肥胖就是白色脂肪组织(WAT)对能量储存需求增加的适应。WAT在肥胖中的扩张以性别和地区依赖的方式发生,其扩张和重塑受到构成WAT微环境的非实质细胞的调节。
单细胞测序(scRNA-seq)揭示了成人白色脂肪组织(WAT)含有功能多样的间充质基质细胞亚群。但迄今为止,这种细胞异质性的分子基础尚未完全确定。
近日,德克萨斯大学和下一代蛋白质组学YCI实验的研究团队联合在Cell Metabolism(IF 27.3)上发表了“Multilayered omics reveal sex- and depot-dependent adipose progenitor cell heterogeneity”的文章,基于单细胞测序的数据分离出白色脂肪组织祖细胞亚群,通过微量蛋白质组学和转录组学描述了脂肪组织祖细胞在三个维度上的mRNA和蛋白质异质性:细胞类型(WAT PDGFRβ+基质细胞亚群),解剖定位(内脏和皮下脂肪库)和性别(雄性和雌性)。

研究材料
雄性和雌性小鼠腹腔和皮下白色脂肪组织分离的基质细胞亚群
技术路线
· 步骤1:通过流式分选出细胞亚群,进行转录组学和蛋白质组学的检测;
· 步骤2:基于组学数据,分析细胞亚群的功能,性别和储库对细胞功能的影响,确认细胞亚群的关键分子机制;
· 步骤3:利用CRISPR Cas9及其他体外实验验证细胞亚群功能及机制。
研究结果
1. 多组学揭示脂肪组织祖细胞异质性为了更加深入了解脂肪祖细胞的异质性,同时考虑到脂肪储库和性别差异,利用流式分选的方法从雄性和雌性小鼠WAT中分别分离了四种主要的祖细胞亚群——PDGFRβ+细胞亚群,包括来自腹腔gWAT的APCs和纤维炎性祖细胞(FIPs),来自皮下iWAT的DPP4-APC和DPP4+APC亚群,进行DIA微量蛋白质组学和转录组学的检测。综合比较发现不同细胞群的功能异质性高于储库或性别差异。
有研究发现WAT PDGFRβ+细胞亚群之间的代谢活性显著不同,脂肪形成与促炎表型受到线粒体代谢的强烈调节。因此将注释为代谢相关的556种蛋白质的表达丰度进行比较,发现即使在稳定状态下,不同亚群之间代谢存在较大差异。而线粒体相关的145种蛋白质的表达以及参与脂质代谢的35种蛋白质均可以清晰的区分雄性与雌性来源细胞。总之,将细胞亚群分离后进行组学分析可以对细胞群体的分子和功能异质性有更加深入的了解。

图1 蛋白质组和转录组数据分析
2. 蛋白质-mRNA相关性不佳
接下来比较了细胞亚群层面上蛋白质和mRNA的相关性,结果发现在成对的4540对蛋白质-mRNA中,有1800对显著性相关,2740对无显著相关性。又将4540个共享基因根据蛋白质丰度CV值分为10组,研究CV值和蛋白质-mRNA相关性之间的关系。结果表明蛋白质和mRNA水平之间的相关性受蛋白质和转录水平丰度变化的高度影响。同时,又比较了性别、储库、细胞亚群、及某些通路或基因集层面上蛋白质与mRNA的相关性,观察结果表明转录水平并不能准确预测其蛋白质丰度,多组学联合可以提供单组学无法获得的附加信息。

图2 mRNA和蛋白质相关性比较
3. 蛋白质组学显示iWAT-APCs分化存在性别差异
数据表明前体细胞中很多基因呈现性别依赖性表达。如雄性小鼠中iWAT-APCs在高脂饮食时对脂肪形成具有抗性,而gWAT-APCs被激活进而分化;雌性小鼠中iWATs和gWAT均可观察到新生脂肪形成。即雌性和雄性的iWAT-DPP4- APCs存在性别差异。蛋白质组学数据集的GSEA分析也揭示了这种差异,特别是与WAT重塑相关的途径,包括雌激素反应、缺氧等。同时发现这些差异在蛋白质水平上比在mRNA水平上更为明显。
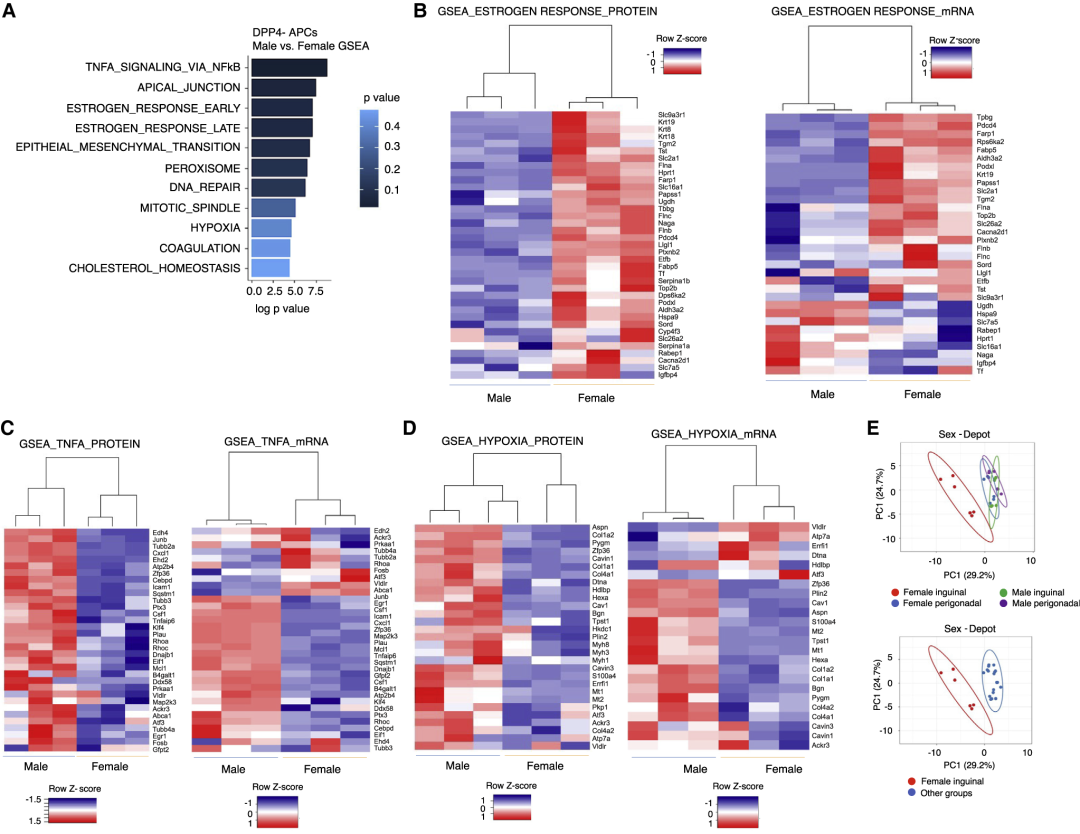
图3 基于蛋白质组学数据的GSEA分析
4. PPARγ磷酸化水平是iWAT-APC分化性别差异的基础
PPARγ是脂肪生成的主要调节因子。脂肪祖细胞内的缺氧诱导因子1a(HIF1A)活化会触发PPARγ信号级联,导致PPARγ的S112位点发生磷酸化,从而抑制PPARγ活性。不同性别中“缺氧”特征的差异表明PPARγS112磷酸化水平可能是PPARγ活性性别依赖的基础。通过高脂饮食喂养后,发现雌性iWAT PDGFRβ+细胞中磷酸化PPARγ的水平明显低于雄性。这表明在饮食诱导的肥胖环境中,PPARγ在APCs中的活性存在性别差异。遗传谱系追踪分析也进一步验证了HFD喂养会导致雌性小鼠iWAT中新生脂肪细胞增多。

图4 不同性别的PPARγ磷酸化水平及成脂差异
5. gWAT APCs和FIPs的功能注释
根据体内外转录分析及后续功能研究证实,APCs是代表gWAT高度定型的前脂肪细胞,而FIPs表现出促炎作用并调节高脂环境的免疫细胞稳定。基于蛋白质组学数据的GSEA分析结果中,与雄性FIPs相比,雄性APCs富集与脂肪生成相关的途径;此外,APCs还富含脂肪酸代谢和胆汁酸代谢的特征,而经由NF-κB的TNF信号通路在FIPs中显著富集。利用IPA分析预测APCs和FIPs的潜在调控机制,发现谷胱甘肽介导的解毒和芳烃受体(AhR)信号传导是雄性APCs中最上调的途径之一。

图5 基于蛋白质组学数据的GSEA及IPA分析
6. GSTM1是APC细胞氧化还原平衡所必须的
谷胱甘肽代谢控制细胞内的氧化还原稳态,是许多细胞过程的必要条件。谷胱甘肽以还原(GSH)和氧化(GSSG)形式存在,GSH:GSSG的比例指示氧化还原状态和氧化应激。谷胱甘肽-S-转移酶(GST)是gWAT-APCs中最富集的蛋白质之一。GST参与GSH途径的氧化还原反应,从而调节GSH:GSSG比率,而GSTM1是丰度最高的。研究发现在APCs中,随着细胞分化,GSH:GSSG显著降低。而改变GSH:GSSG比率,会影响APCs的分化,但对FIPs无明显作用。在APCs自发分化过程中,GSTM1 RNA和蛋白质均稳定增加,利用CRISPR基因编辑技术抑制APCs和FIPs细胞中的GSTM1,GSH:GSSG比率的下降几乎被完全阻断,也就说明GSTM1作为gWAT-APCs中细胞内谷胱甘肽代谢的主要酶。

图6 APCs细胞内氧化还原稳态
7. AhR信号抑制FIPs和APCs炎症反应
AhR是参与调节各种细胞类型的炎症反应的受体和转录因子。通过CRISPR-Cas9构建AhR缺陷型ACPs和FIPs,用LPS处理后采用微量蛋白质组学进行检测,结果显示ACPs和FIPs的促炎基因表达水平提升,包括细胞因子/趋化因子。收集添加LPS的AhR缺陷型FIPs的培养基,用于培养巨噬细胞,发现巨噬细胞被活化。这表明AhR缺陷型FIPs表现出增强的促炎表型。

图7 促炎基因的表达
小编小结
单细胞层面的研究使得我们更加清楚看到每个细胞的特征,看到组织中复杂的细胞群体的构成,以及新的细胞亚群等等。但细胞亚群的分子异质性很难在单细胞层面去研究。本研究将单细胞测序发现的关键细胞亚群分别分离出来进行蛋白质组和转录组的检测,探索了蛋白质/基因的分子机制,对细胞亚群的异质性有了更加深入的了解。
中科优品推荐
【中科新生命】已建立从真正单细胞,到几十上百个细胞,到上万个细胞的全系列蛋白质组学检测平台,满足您单细胞、分选细胞亚类、原代细胞、稳定细胞系等等不同的研究需求,欢迎前来咨询!