上海中科新生命生物科技有限公司
18 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Cell Death Differ报道实现磷酸化与泛素化的交互应答研究(crosstalk)
459 人阅读发布时间:2021-07-20 09:15
泛素化是生物体内非常重要的蛋白翻译后修饰,介导了真核生物体内80%~85%的蛋白质降解。 该降解途径是调控蛋白表达水平的重要机制,通过对蛋白质稳定性、定位、活性以及相互作用的调控,广泛参与转录调节细胞凋亡、囊泡运输等生理过程。磷酸化也是蛋白质组中普遍存在的翻译后修饰,在细胞信号转导中发挥重要作用。
目前的研究证明,泛素化与磷酸化间存在着密切的交互应答(cross-talk),但磷酸化和泛素化间的交互应答形式和具体机制并未完全明确。
本次小编给大家带来一篇从磷酸化角度研究泛素化调控机制的前沿进展,该项研究由中科院上海药物所谭敏佳课题组和江苏海洋大学刘彬教授团队共同完成,并于2021年7月2日在线发表在Cell Death & Differentiation杂志。该项研究成果采用大规模全景式的方式鉴定了泛素E3连接酶底物SCF(SKP1-CUL1-F-box)的磷酸化位点,并且发现了全新的受FBXO22识别的磷酸化降解结构域XXPpSPXPXX,通过识别该结构域进而引起泛素化降解。
该项研究全面揭示了蛋白磷酸化修饰在SCF 复合体介导的底物蛋白泛素化降解过程中的普遍性和特异性,为深入研究磷酸化修饰和泛素化修饰的交互作用(cross-talk)提供了崭新的思路。
目前的研究证明,泛素化与磷酸化间存在着密切的交互应答(cross-talk),但磷酸化和泛素化间的交互应答形式和具体机制并未完全明确。
本次小编给大家带来一篇从磷酸化角度研究泛素化调控机制的前沿进展,该项研究由中科院上海药物所谭敏佳课题组和江苏海洋大学刘彬教授团队共同完成,并于2021年7月2日在线发表在Cell Death & Differentiation杂志。该项研究成果采用大规模全景式的方式鉴定了泛素E3连接酶底物SCF(SKP1-CUL1-F-box)的磷酸化位点,并且发现了全新的受FBXO22识别的磷酸化降解结构域XXPpSPXPXX,通过识别该结构域进而引起泛素化降解。
该项研究全面揭示了蛋白磷酸化修饰在SCF 复合体介导的底物蛋白泛素化降解过程中的普遍性和特异性,为深入研究磷酸化修饰和泛素化修饰的交互作用(cross-talk)提供了崭新的思路。

Global identification of phospho-dependent SCF substrates reveals a FBXO22 phosphodegron and an ERK-FBXO22-BAG3 axis in tumorigenesis
1. 利用定量蛋白质组学和磷酸化组学的方法,筛选磷酸化依赖的SCF潜在泛素化降解底物
为了鉴定CRLs(Cullin-RING ligases)的磷酸化依赖的泛素化底物,使用定量蛋白质组学和磷酸化蛋白组学的方法定量MLN4924诱导改变的蛋白、磷酸化蛋白和磷酸化位点(图1A)。通过大规模检测,共鉴定到8286个蛋白、12276个可信度较高的磷酸化位点和4322个磷酸化蛋白。
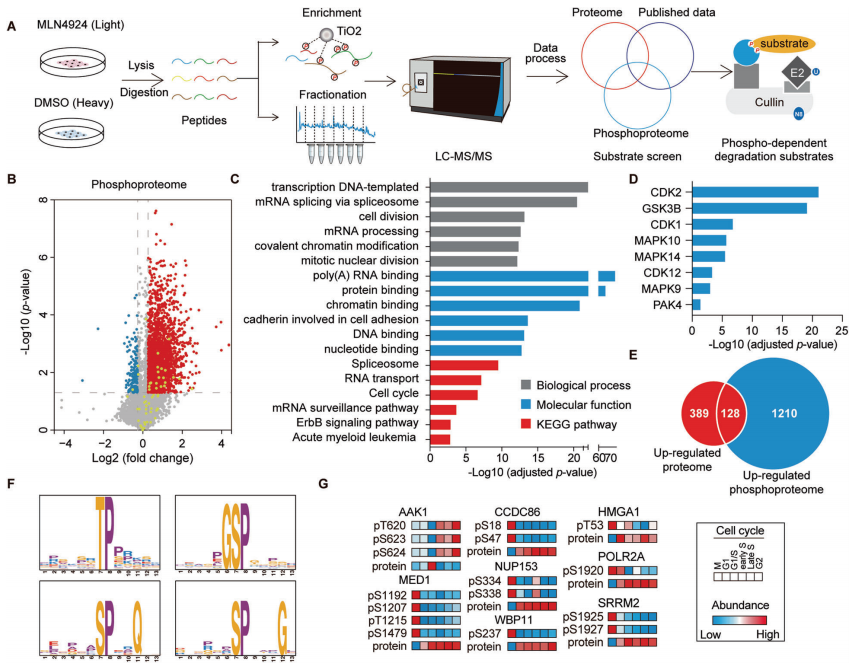
为了确定新的SCF磷酸化依赖的泛素化底物,作者将上述蛋白组学和磷酸化蛋白组学得到的结果与SCF-associated interactome相比对,共筛选到16个已报道的和38个未报到的SCF底物(图2A)。通过免疫印迹实验以及磷酸化位点突变等实验,最终确定BAG3、UFD1和PRKAR1A这三个蛋白确为SCF的底物且蛋白的磷酸化是SCF依赖的泛素化降解的必要条件。
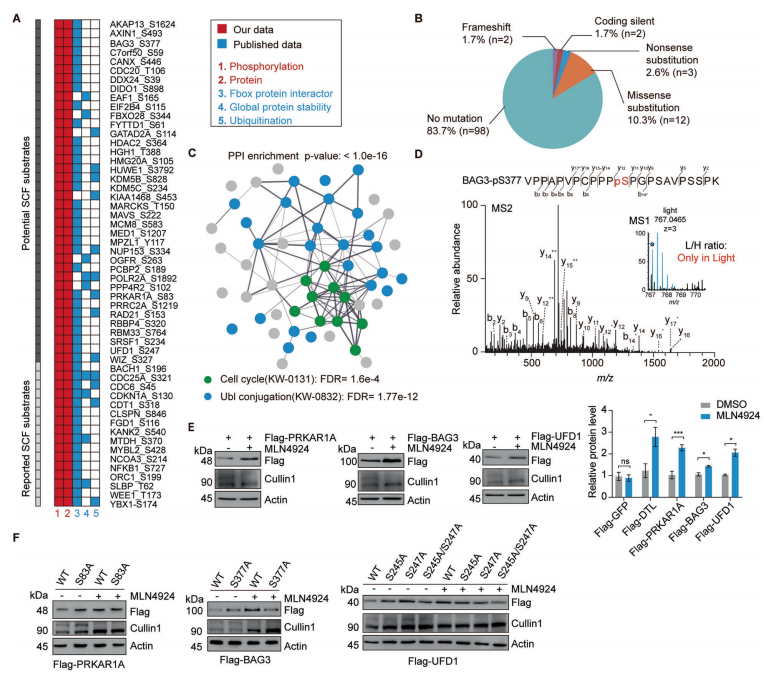
为了探究FBXO22调控BAG3降解的机制,通过过表达、敲除FBXO22以及添加蛋白酶抑制剂的多种实验方法验证了FBXO22对BAG3的调控(图4A、4B、4C和4D)。接着作者将FBXO22蛋白C末端、BAG3的S377位点分别进行点突变做免疫沉淀实验,证实FBXO22蛋白上与BAG3的结合位点以及BAG的降解需要S377位点的参与(图4G、4H和4I)。另外研究发现ERK在BAG3 S377位点的磷酸化和BAG3的降解中发挥了重要作用(图4K)。

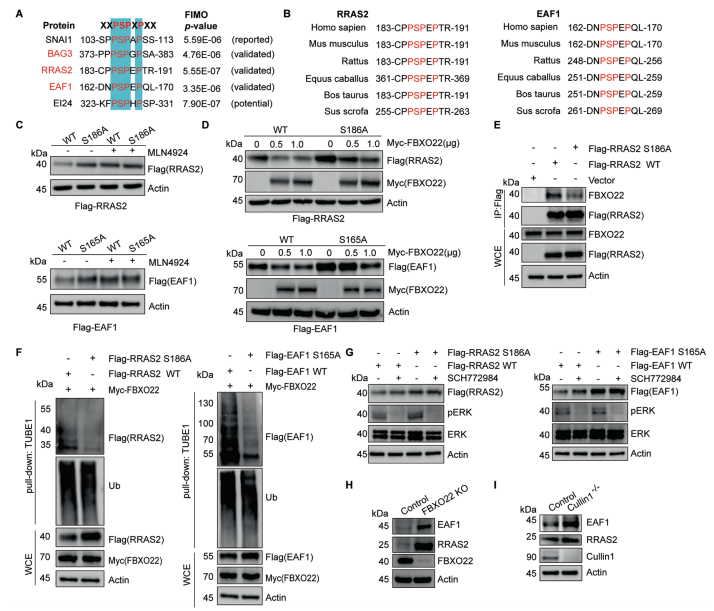
通过将BAG3蛋白上S377位点附近的序列与多物种的序列比对、与SNAI1(已报道的FBXO22底物)的序列做比对,作者发现了磷酸化降解结构域--XXPpSPXPXX结构域(图4E和图4F),随后作者使用FIMO软件以及生化实验进一步确认该结构域是否为保守的磷酸化降解结构域。在生化实验中, RRAS2、EAF1蛋白(与BAG3发挥同样重要作用且具有相似的结构域的蛋白)经位点突变后,不响应MLN4924的处理(图5C)亦不能与FBXO22结合(图5E)。
5. BAG3 降解生物学功能研究
通过体内和体外实验发现,BAG3 S377位点的突变会引起肿瘤的生长(图6A和6B)。为了更进一步深入了解FBXO22-BAG3调控轴,本研究中开展了定量蛋白组学实验。与之前的结果一致,在FBXO22敲除的细胞中,BAG3的蛋白水平上升(图6C)。在FBXO22敲除的细胞中,BAG3基因的沉默也会显著降低细胞的增殖和迁移能力(图6G)。
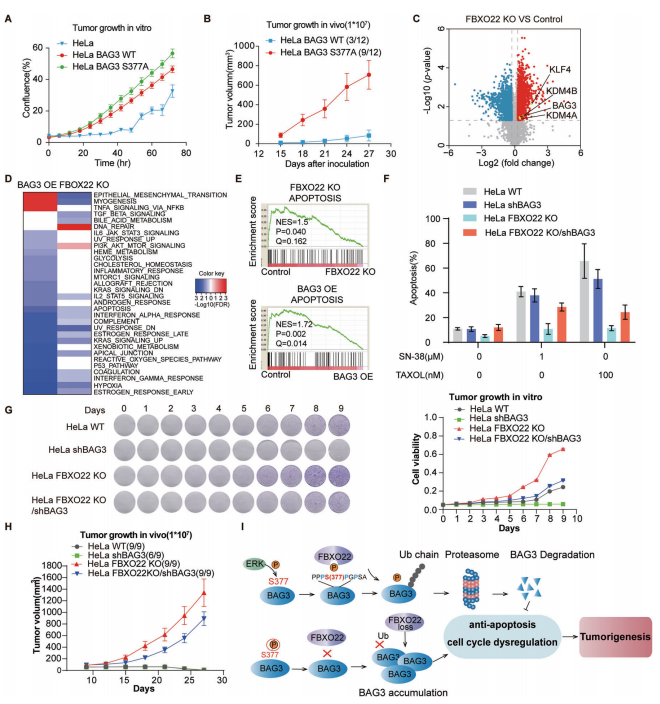
该项研究通过多种分子生物学和蛋白质组学策略,揭示了SCFFBXO22为BAG3的泛素E3连接酶,FBXO22通过对ERK催化的BAG3的S377位点的磷酸化进行识别,进而促进BAG3的泛素化降解,进一步证明了ERK-FBXO22-BAG3调控轴在肿瘤发生发展中的新机制。生命活动的调节过程并不是单一的调控过程,涉及到复杂的调控网络。泛素化和磷酸化作为真核生物中最常见的蛋白翻译后修饰,对于蛋白活性、蛋白表达量以及蛋白功能调节具有至关重要的作用,多项研究表明他们之间存在着相互调节的作用(cross-talk)。本研究成果对于两种修饰之间的研究提供了很好的范例,也是值得去深入探索的方向。